





|
1.4 氨的合成 |

|
氨的合成是整个合成氨生产的核心部分。在较高的温度、压力和活性催化剂存在下,经过精制的氢、氮混合原料气直接反应生成氨。由于受化学平衡及操作条件的限制,反应后气体混合物中氨含量不高,一般只有 10%~20%,必须将氨从混合物中分离出来,才能制得产品氨。未反应的气体除少数为排放惰性气体而放空或作一段燃料气之外,其余均循环使用。
 1.4.1 氨合成反应的热力学基础
1.4.1 氨合成反应的热力学基础
1)化学平衡
由氢气和氮气合成氨的反应如下:

此反应具有可逆、放热和体积缩小的特点。根据这些特点,可选择适当的操作条件,促使平衡向着合成氨的方向移动。高压下,反应平衡常数应以逸度表示:

(1.4.1)
实验平衡常数
 与温度、压力和组成都有关。在氢氮比为 3 时,
与温度、压力和组成都有关。在氢氮比为 3 时,
 与温度、压力的关系如表 1.9 所示。表中列出的数据表明,温度越高,平衡常数越低;而压力增大,平衡常数增加不明显。也就是说,平衡常数的大小虽与温度、压力(高压)都有关系。但在一定的压力范围内和确定的温度下,平衡常数随压力的变化不显著;而在压力相同的条件下,平衡常数随温度变化较显著。
与温度、压力的关系如表 1.9 所示。表中列出的数据表明,温度越高,平衡常数越低;而压力增大,平衡常数增加不明显。也就是说,平衡常数的大小虽与温度、压力(高压)都有关系。但在一定的压力范围内和确定的温度下,平衡常数随压力的变化不显著;而在压力相同的条件下,平衡常数随温度变化较显著。
表 1.9 实验测得氨合成反应的平衡常数


在 1.0~100 MPa的范围内,氨合成反应的平衡常数随温度变化的经验关系式为:

(1.4.2)
式中 T ——温度,K;
B , I ——经验系数,与压力有关,如表 1.10 所示。
表 1.10 系数 B , I 与压力的关系

在已知温度、压力条件下,可计算出平衡常数和平衡组成。
2)平衡氨摩尔分数
平衡氨摩尔分数是在一定的温度、压力和氢氮比等条件下,反应达到平衡时,氨在气体混合物中的摩尔分数。平衡氨摩尔分数即反应的理论最大产量,通过计算可以找出实际产量与理论产量的差距,为指导生产和选择最佳工艺条件,提供理论依据。
设混合气体中含有N 2 ,H 2 ,NH 3 和惰性气体,其摩尔分数分别用 x (N 2 ), x (H 2 ), x (NH 3 ), x i 表示。当氢氮比 r = 3 时,可得出平衡转化率的关系为:

(1.4.3)
若体系中无惰性气体,并令
 =
L
,则可得:
=
L
,则可得:

(1.4.4)
如果温度、压力已知,即可计算出平衡氨摩尔分数。
表 1.11 列出了不同温度、压力时平衡氨摩尔分数的数据。数据表明,压力一定时,平衡氨摩尔分数随着反应温度的升高而下降;温度一定时,平衡氨摩尔分数随着反应压力的增加而增大。所以,从热力学观点来看,合成氨的反应宜在高压、低温下进行。
表 1.11 n (H 2 )∶ n (N 2 )= 3 的平衡氨摩尔分数

3)影响平衡氨摩尔分数的因素
当氢氮比为 r 时,式(1.4.3)可写为:

(1.4.5)
不难看出,影响平衡氨摩尔分数的因素有总压
P
、平衡常数
 (温度)、氢氮比
r
和惰性气体含量
x
i
。其中,温度(平衡常数)和压力对平衡氨摩尔分数的影响已有讨论。下面主要讨论氢氮比和惰性气体体积分数对平衡氨摩尔分数的影响。
(温度)、氢氮比
r
和惰性气体含量
x
i
。其中,温度(平衡常数)和压力对平衡氨摩尔分数的影响已有讨论。下面主要讨论氢氮比和惰性气体体积分数对平衡氨摩尔分数的影响。
(1)氢氮比的影响
式(1.4.5)表明,平衡氨摩尔分数与
r
有关。当温度、压力一定时,
 为定值。若惰性气体的体积分数为已知,则式(1.4.5)为
r
的函数,在某一个
r
时,平衡氨摩尔分数有一个最大值。使平衡氨摩尔分数为最大值的条件为:
为定值。若惰性气体的体积分数为已知,则式(1.4.5)为
r
的函数,在某一个
r
时,平衡氨摩尔分数有一个最大值。使平衡氨摩尔分数为最大值的条件为:
即

解此方程得, r = 3。即当氢氮比等于反应计量比时,平衡氨摩尔分数最大。
但在实际生产中,压力比较高,应考虑与 r 有关的组分逸度系数,所以 r = 3 并不是高压下的正确结论。实践证明,平衡氨摩尔分数最大时的氢氮比为 2.9~3.0。
(2)惰性气体体积分数的影响
习惯上把不参与反应的气体(CH 4 ,Ar等)称为惰性气体,它对平衡氨摩尔分数有明显影响。因为 x i 相对很小,可以将式(1.4.3)近似转化为:

得

(1.4. 6)
式(1.4.6)表明平衡氨摩尔分数随着惰性气体体积分数的增加而减少。在氨合成反应中,由于惰性气体不参与反应,在循环过程中越积越多,对提高平衡氨摩尔分数极为不利。因此,在生产中往往要被迫放空一部分循环气体,使惰性气体保持一稳定值。放空气量可从物料衡算中求出。在图 1.29 所示的循环操作中,设新鲜原料气的进料量为 N F mol/h,放空气量为 N P mol/h,原料气中惰性气的分率为 i F ,放空气中惰性气的分率为 i P ,则物料衡算式为 N F × i F = N P × i P 。

图 1.29 氨合成的循环操作流程
综上所述,提高平衡氨摩尔分数的途径为降低温度,提高压力,保持氢氮比为 r = 3 左右,并减少惰性气体含量。
4)反应热的计算
研究化学反应的热量问题,在化工设计和化工生产中具有重要的意义。如CO的变换反应,反应放出大量的热量。对小型合成氨厂来说,放出的热量可以用来生产 1/6 以上的合成氨。为此,首先要求准确地计算出变换反应放出的热量,然后根据放出热量的多少设计制造热交换设备。化学反应热效应数据是化工设计的重要依据。
对合成氨反应来说,由纯氢、氮完全转化为氨的反应热Δ H 可用以下经验公式计算:

式中 T ——温度,K;
p ——压力(表),MPa;
Δ H ——反应热效应,J/mol。
 1.4.2 氨合成反应的动力学基础
1.4.2 氨合成反应的动力学基础
前面主要从热力学角度讨论了平衡氨摩尔分数的影响因素。然而在实际生产中,不仅要求有较高的产率或转化率,还要求有较高的速度,以提高单位时间内的产量。
对氨合成反应来说,若无催化剂存在,即使在几百个大气压和几百度的温度下进行反应,其速度也极其缓慢。在实际生产中,为了提高氨合成反应的速度,必须在催化剂存在的条件下进行反应。为此,应首先了解在有催化剂存在的条件下,氨合成反应的机理,进而研究其速度方程。
1)催化剂
长期以来,人们对氨合成反应的催化剂做了大量的研究工作,发现对氨合成反应具有活性的一系列金属中,以铁为主体,并添加有促进剂的催化剂,价廉易得,活性良好,使用寿命长,因而铁系催化剂获得广泛的应用。
(1)催化剂的化学成分和作用
目前,大多数铁系催化剂都是用经过精选的天然磁铁矿通过熔融法制得,其活性组分为金属铁。未还原前为FeO和Fe 2 O 3 ,其中FeO的质量分数为 24%~38%, n (Fe 2+ )/ n (Fe 3+ )约为0.5,一般在 0.47~0.57,成分可视为Fe 3 O 4 ,具有尖晶结构。作为促进剂的成分有Al 2 O 3 ,K 2 O,CaO,MgO和SiO 2 等多种。
加入Al 2 O 3 的作用:它能与氧化铁生成FeAl 2 O 4 (或FeO·Al 2 O 3 )晶体,其晶体结构与Fe 2 O 3 ·FeO相同。当催化剂被氢氮混合气还原时,氧化铁被还原为α型纯铁,而Al 2 O 3 不被还原,它环绕在αFe晶粒的周围,防止活性铁的微晶在还原及使用过程中进一步长大。这样αFe的晶粒间就出现了空隙,形成纵横交错的微型孔道结构,大大增加了催化剂的表面积,提高了活性。
加入MgO的作用:与Al 2 O 3 有相似之处。在还原过程中,MgO也能防止活性铁的微晶进一步长大。但其主要作用是增强催化剂对硫化物的抗毒能力,并保护催化剂在高温下不致因晶体破坏而降低活性,故可延长催化剂寿命。
加入CaO的作用:降低熔融物的熔点和黏度,并使Al 2 O 3 易于分散在FeO·Fe 2 O 3 中,还可提高催化剂的热稳定性。
加入K 2 O的作用:促使催化剂的金属电子逸出功的降低。因为氮被吸附在催化剂表面,形成偶极子时,电子偏向于氮。电子逸出功的降低有助于氮的活性吸附,从而使催化剂的活性提高。实践证明,只有在加入Al 2 O 3 的同时再加入K 2 O才能提高催化剂的活性。
SiO 2 成分:一般是磁铁矿的杂质,具有中和K 2 O,CaO等碱性组分的作用,此外还具有提高催化剂抗水毒害和耐烧结的作用。
通常制成的催化剂为黑色不规则颗粒,有金属光泽,堆积密度为2.5~3.0 kg/dm 3 ,空隙率为 40%~50%。
催化剂还原后,FeO·Fe 2 O 3 晶体被还原成细小的αFe晶体,它们疏松地处在氧化铝的骨架上。还原前后表观容积并无显著改变,因此,除去氧后的催化剂便成为多孔的海绵状结构。催化剂的颗粒密度与纯铁的密度 7.86 g/cm 3 相比要小得多,这说明孔隙率是很大的。一般孔呈不规则树枝状,还原态催化剂的内表面积为 4~16 m 2 /g。国内外氨合成催化剂的一般性能如表 1.12 所示。
表 1.12 氨合成催化剂的一般性能

(2)催化剂的还原与使用
合成氨催化剂的活性不仅与化学组成有关,在很大程度上还取决于制备方法和还原条件。催化剂还原的反应式为:
FeO·Fe 2 O 3 +4H 2 ═3Fe+4H 2 O(g)
确定还原条件的原则一方面是使FeO·Fe 2 O 3 充分还原为αFe,另一方面是还原生成的铁结晶不因重结晶而长大,以保证有最大的比表面积和更多的活性中心。为此,宜选取合适的还原温度、压力、空速和还原气组成。
还原温度的控制对催化剂活性影响很大。只有达到一定温度,还原反应才开始进行。提高还原温度能加快还原反应的速度,缩短还原时间;但催化剂还原过程也是纯铁结晶组成的过程,要求αFe型铁晶体越细越好。还原温度过高会导致αFe型铁晶体的长大,从而减小催化剂表面积,使活性降低。实际还原温度一般不超过正常使用温度。
降低还原气体中的 p (H 2 O)/ p (H 2 )有利于还原,为此还原气中氢含量宜尽可能高,水汽含量尽可能低。尤其是水汽含量的高低对催化剂活性影响很大,水蒸气的存在可以使已还原的催化剂反复氧化,造成晶粒变粗,活性下降。为此要及时除去还原生成的水分,同时尽量采用高空速以保持还原气中的低水汽含量。还原压力较低为宜,但仍要维持一定的还原空速(10 000 h -1 以上)。
工业上还原过程多在氨合成塔内进行,还原温度借外热(如电加热器)维持,并严格按规定的温度-时间曲线进行。一般温度升至 300℃左右开始出水,以后升温与维持温度出水交替进行。最后还原温度在 500~520℃,视催化剂类型而定。
催化剂的还原也可在塔外进行,即催化剂的预还原。采用预还原催化剂不仅可以缩短合成塔的升温还原时间,而且也避免了在合成塔内不适宜的还原条件对催化剂活性的损害,使催化剂得以在最佳条件下进行还原,有利于提高催化剂的活性,为强化生产开辟了新的途径。还原后的活性铁,遇到空气后会发生强烈的氧化燃烧以致使催化剂烧结失去活性。为此,预还原后的催化剂必须进行“钝化”操作,即在 100~140℃下,用含少量氧的气体缓慢加以氧化,使催化剂表面形成氧化铁保护膜。使用预还原催化剂的氨合成塔,只需稍加还原即可投入生产操作。
在催化剂使用过程中,能使催化剂中毒的物质有氧及氧的化合物(O 2 ,CO 2 ,H 2 O等)、硫及硫的化合物(H 2 S,SO 2 等)、磷及磷的化合物(PH 3 )、砷及砷的化合物(AsH 3 )以及润滑油、铜氨液等。硫、磷、砷及其化合物的中毒作用是不可逆的。氧及氧化合物是可逆毒物,中毒是暂时性的,一旦气体成分得以改善,催化剂的活性是可以恢复的。气体中夹带的油类或高级烃类在催化剂上裂解析炭,起到堵塞毛孔、遮盖活性中心的作用,后果介于可逆与不可逆中毒之间。另外,润滑油中的硫分同样可引起催化剂中毒。采用铜洗净化操作的合成氨系统,若将铜氨液带入合成塔中,则催化剂表面被覆盖也会造成催化剂活性降低,在生产中应予以十分注意。为此,原料气送往合成系统之前应充分清除各类毒物,以保证原料气的纯度。
此外,氨合成塔停车时降温速度不能太快,以免催化剂粉碎,卸出催化剂前一般进行钝化操作。
2)反应机理与动力学方程
对氨合成反应的机理,已经研究了几十年,提出过许多不同的观点。目前普遍采用的观点是,气相中氢和氮分子首先扩散到催化剂表面,并被催化剂的活性表面所吸附,氮分子离解为氮原子,氮原子与催化剂进行化学反应,生成某中间产物,然后逐步地生成NH,NH 2 ,NH 3 ,最后氨分子从催化剂表面脱附,再扩散到气相中。
在这些步骤中,氮在催化剂表面上的活性吸附是氨合成反应中最慢的控制步骤。因为根据大量的实验结果,发现氮在铁催化剂上的吸附速度,在数值上很接近氨的合成速度,这可作为确定氮的活性吸附为控制步骤的一个依据。
根据这一观点,导出了氨合成反应的速度方程:

(1.4.7)
氨合成反应的净速度
r
(NH
3
)为正反应速度
k
1
p
(N
2
)
 与逆反应速度
与逆反应速度
 之差。
k
1
,
k
2
分别为正逆反应速度常数;
α
为由实验测定的常数,与催化剂的性质及反应条件有关,通常 0 <
α
< 1。对以铁为主的氨合成催化剂而言,
α
= 0.5,此时式(1.4.7)可写成:
之差。
k
1
,
k
2
分别为正逆反应速度常数;
α
为由实验测定的常数,与催化剂的性质及反应条件有关,通常 0 <
α
< 1。对以铁为主的氨合成催化剂而言,
α
= 0.5,此时式(1.4.7)可写成:

(1.4.8)
反应达到平衡时, r (NH 3 )=0,整理后得:

(1.4.9)
式(1.4.8)只适用于常压或反应接近于平衡状态的情况。当反应远离平衡态时,则不适用。特别是当 p (NH 3 )= 0 时,根据式(1.4.8), r (NH 3 )→∞,这是不合理的。
3)影响反应速度的因素
(1)空间速度
空间速度是单位时间、单位体积的催化剂上通过的气体体积(通常用标准状态下的气体体积表示)。单位一般用m 3 /(m 3 ·h)或h -1 表示。
合成氨的原料气是循环使用的,当操作压力及进合成塔气体组成一定时,对于既定结构的氨合成塔,可采用增加空速,以提高合成塔单位时间的产量。
若已知空间速度和合成塔进、出口氨摩尔分数,则可由下面两个式子计算合成塔的产氨速度α和催化剂生产强度G:

(1.4.10)

(1.4.11)
式中 n 1 , n 2 ——进、出塔气体摩尔流量,kmol /h;
Z 1 , Z 2 ——进、出塔气体的氨摩尔分数;
V 1 , V 2 ——进出塔的空间速度,h -1 ;
n 0 ——氨分解基气体流量,kmol /h; n 0 = n 1 /(1+ Z 1 )= n 2 /(1+ Z 2 );
V 0 ——氨分解基空间速度,h -1 ;
α ——合成塔产氨速率,kmol /h;
G ——催化剂生产强度,kg/(m 3 ·h)。
由式(1.4.11)可知,在其他条件一定时,增大空速能提高催化剂生产强度。但加大空速,系统阻力增大,循环功耗增加,氨分离所需的冷冻负荷也增大。同时,当单位循环气量的产氨量减少,所获得的反应热相应减少。当单位循环气的反应热降到一定程度时,合成塔就难以维持“自热”。
操作压力为 30 MPa的中压法合成氨,一般空速在 20 000~30 000 h -1 。大型合成氨厂为了充分利用反应热,降低功耗并延长催化剂使用寿命,通常采用较低的空速。如操作压力15 MPa的轴向冷激式合成塔,空速为 10 000 h -1 。
(2)温度
合成氨是一个可逆的放热反应,反应速度并不是随温度的升高而单调地增大。实际情况是在较低的温度范围内,随着温度的升高,反应速度相应地增大,当温度继续升高到某一值时,反应速度达到最大值,再继续升高温度,反应速度逐渐变小。因此,要想得到最高的反应速度,并不是温度越高越好,而是有一个最适宜温度( T o )。最适宜温度 T o 与平衡温度 T e 之间的关系,其理论原理和公式与变换反应相同,不再重复。
图 1.30 为平衡温度曲线和某催化剂的最适宜温度曲线。在一定的压力下,氨摩尔分数 x (NH 3 )提高,相应的平衡温度与最适宜温度下降。惰性气体体积分数增高,对应于一定氨摩尔分数的平衡温度下降。氮氢比对最适宜温度的变化规律与对平衡温度的影响相同。

图 1.30
n
(H
2
)∶
n
(N
2
)= 3 条件下的平衡温度与最适宜温度
1,6—30 MPa,
x
i
= 0.12 下平衡温度线和最佳温度线;2,7—30 MPa,
x
i
= 0.15 下平衡温度线和最佳温度线;3,8—20 MPa,
x
i
= 0.15 下平衡温度线和最佳温度线;4,9—20 MPa,
x
i
= 0.18 下平衡温度线和最佳温度线;5,10—10~15 MPa,
x
i
= 0.13 下平衡温度线和最佳温度线
压力改变时,最适宜温度也相应改变。气体组成越高,平衡温度与最适宜温度越高。
事实上,一定系统的平衡温度与最适宜温度有相应的变化关系,压力、气体组成都不影响 T o 与 T e 之间的相对关系,只要催化剂的活性不变, E 1 和 E 2 一定,则 T e 与 T o 之间的相对关系就不会改变。由式(1.3.8),催化剂活性高时(性能良好或使用初期), E 1 和 E 2 都较低,由于二者差值不变, E 2 / E 1 比值增大,则 T e 与 T o 差值增大,最适宜温度下降;反之,活性差时(性能差、衰老或中毒)最适宜温度上升。
从理论上看,合成氨的反应按最适宜温度曲线进行时,催化剂用量最少,合成效率最高。但在反应初期,合成氨反应速度很高,故实现最适宜温度不是主要问题,而实际上受种种条件的限制不可能做到这一点。例如,氨合成塔进气中氨含量为4%( P = 30 MPa, x i0 = 0.12),由图1.30 可知, T o 已超过 600℃,也就是说催化剂床层入口温度应高于 600℃,而后床层轴向温度逐渐下降。此外,温度分布递降的反应器在工艺实施上也不尽合理,它不能利用反应热使反应过程自然进行,需额外加高温热源预热反应气体以保证入口的温度。所以,在床层的前半段不可能按最适宜温度操作。在床层的后半段,氨含量已经比较高,反应温度依最适宜温度曲线操作是可能的。
氨合成反应温度一般控制在 400~500℃(依催化剂类型而定)。催化剂床层的进口温度比较低,大于或等于催化剂使用温度的下限,依靠反应热床层温度迅速提高,而后温度再逐渐降低。床层中温度最高点,称为“热点”,不应超过催化剂的使用温度。到生产后期,催化剂活性已下降,操作温度应适度提高。
(3)压力
增大压力,氢氮气的分压也相应增加,这样也必然增加它们相互碰撞的机会,导致净反应速度大大增加,从合成氨的动力学方程式:

(1.4.12)
可以进一步理解压力对反应速度的影响。增大体系的压力时,对速度方程中的反应速度常数 k 1 , k 2 一般影响不大。但从各组分的分压来考虑,提高压力,各组分的分压相应增大。从速度方程不难看出,提高压力将使正反应速度增大,而逆反应速度减小,其结果是净反应速度增大。例如,在 500℃、氢氮比为 3、空间速度为 30 000 h -1 条件下,当压力从 20 MPa增加到 60 MPa时,氨体积分数将由 14%增加到 28%,即提高了 1 倍。
(4)氢氮混合气体的组成
气体组成的选择也是影响反应速度的一个重要因素。从化学平衡的角度来看,氢氮比应为 3;但从动力学的角度来看,氨合成反应的机理为氮的活性吸附所控制。所以,在氨的体积分数远离平衡时,与氮的浓度有关,即在氨的浓度较低时,可以适当地提高氢氮混合气中氮的浓度(分压)。当氨体积分数接近平衡值时,最适宜的氢氮混合比趋近于 3,但生产实践中控制进合成塔的氢氮比略低于 3。
 1.4.3 氨的合成工艺与设备
1.4.3 氨的合成工艺与设备
氨合成的主要任务是将脱硫、变换、净化后送来的合格的氢氮混合气,在高温、高压及有催化剂存在的条件下直接合成氨。
1)最佳工艺条件的选择
在前面我们已经讨论了氨合成反应的热力学和动力学条件。在此基础上,将综合选择合成氨的最佳工艺条件,主要包括压力、温度、空速、气体组成等。
(1)压力
工业上合成氨的各种工艺流程,一般都以压力的高低来分类。高压法压力为 70~100 MPa,温度为 550~650℃ ;中压法压力范围可达 40~60 MPa,一般采用 30 MPa左右,温度为 450~550℃ ;低压法压力为 10~15 MPa,温度为 400~450℃。我国中型合成氨厂一般采用中压法进行氨的合成,压力一般采用 32 MPa左右。但从当前节省能源的观点出发,有向降低压力方向发展的趋势,如从国外引进的 30 万t大合成氨厂压力为 15 MPa。
从化学平衡和化学反应速度两方面考虑,提高操作压力可以提高生产能力。而且压力高时,氨的分离流程可以简化。如高压下分离氨只需水冷却就足够,设备较为紧凑,占地面积也较小。但是压力高对设备材质、加工制造要求均高。同时,高压下反应温度一般较高,催化剂使用寿命缩短。
生产上选择压力的主要依据是能源消耗、原料费用、设备技术、技术投资在内的综合费用,也就是说主要取决于技术经济效果。
(2)温度
实际生产中,希望合成塔催化剂层中的温度分布尽可能接近最适宜温度曲线。由于催化剂只有在一定的温度条件下才具有较高的活性,还要使最适宜温度在催化剂的活性温度范围内。如果温度过高,会使催化剂过早地失去活性;而温度过低,达不到活性温度,催化剂起不到加速反应的作用。不同的催化剂有不同的活性温度。同一种催化剂在不同的使用时期,其活性温度也有所不同。对A6 型催化剂而言,催化剂在使用初期活性较高,反应温度可以控制低一点(480℃),使用中期活性下降,温度控制在最适宜温度(500℃);使用后期,因活性较差,温度可以控制高一点(520℃)。
在生产中,控制最适宜温度是指控制“热点”温度,“热点”温度就是在反应过程中催化剂层中温度最高的那一“点”。下面以双套管并流式催化剂筐为例分析,如图 1.31 所示。

图 1.31 催化剂层不同高度的温度分布和氨体积分数的变化
L
1
—绝热层高度;
L
2
—冷却层高度;
L
—催化剂高度;
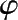 (NH
3
)—进口氨体积分数;
(NH
3
)—进口氨体积分数;
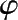 ′(NH
3
)—出口氨体积分数;
t
1
—催化剂层进口温度;
t
2
—出口温度;
t
热
—热点温度
′(NH
3
)—出口氨体积分数;
t
1
—催化剂层进口温度;
t
2
—出口温度;
t
热
—热点温度
设气体进入催化剂层时的温度和氨体积分数分别为
t
1
和
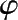 (NH
3
)。要求
t
1
大于或等于催化剂使用温度的下限。反应初期,因远离平衡态,氨合成反应速度较快,放热多,为使温度迅速升至最适宜温度,这一段不设冷却管冷却(即图中
L
1
那一段),故称绝热层。在
L
1
一段,氨的浓度也迅速增加。
(NH
3
)。要求
t
1
大于或等于催化剂使用温度的下限。反应初期,因远离平衡态,氨合成反应速度较快,放热多,为使温度迅速升至最适宜温度,这一段不设冷却管冷却(即图中
L
1
那一段),故称绝热层。在
L
1
一段,氨的浓度也迅速增加。
随着温度升高到一定程度,温度上升的速度逐渐缓慢,而且反应后的气体与双套管内的冷气相遇,反应热开始逐步移走。当温度达到最高点后,由于移走的热量超过反应所放出的热量,温度就随催化剂床层深度的增加而降低。在催化剂层中温度最高的那一点即为“热点”。
从较理想的情况来看,希望从 t 1 — t 热 这一段进行得快一些,从 t 热 — t 2 (气体出催化剂层的温度)则尽可能沿着最适宜温度线进行。
(3)空间速度
空间速度的大小意味着处理量的大小,在一定的温度、压力下,增大气体空速,就加快了气体通过催化剂的速度,气体与催化剂接触时间缩短,在确定的条件下,出塔气体中氨体积分数要降低。每个空间速度有一个最适宜温度和氨体积分数,如表 1.13 所示。
表 1.13 空间速度和NH 3 体积分数与温度的关系

压强为 30 MPa的中压法合成氨,空间速度选择 20 000~30 000 h -1 ,氨净值(出塔与进塔氨体积分数之差)为 10%~15%。因合成氨是循环流程,空速可以提高。空速大,处理的气量大。虽然氨净值有所降低但能增加产量。但空速过大,氨分离不完全,增大设备负荷和动力消耗。
关于氢氮比和惰性气体体积分数对氨体积分数的影响在前面已讨论过。
实际生产控制进塔氢氮比略低于 3,循环气中惰性气体体积分数应根据操作压强、催化剂活性等条件而定。若以增产为主,惰性气体可控制低一点,为 10%~14%。若以降低原料成本为主时,可控制略高一点,为 16%~20%。
2)氨的分离及合成流程
(1)氨分离的方法
①冷凝法。冷凝法是冷却含氨混合气,使其中大部分氨冷凝与不凝气分开。加压下,气相中饱和氨含量随温度降低、压力增高而减少。若不计惰性组分对氨热力学性质的影响,不同温度、压力下气体中的饱和氨含量可由下式计算:

(1.4.13)
式中 y a ——气相中平衡氨含量,%;
p ——混合气体压力,MPa;
T ——温度,K。
若考虑到其他气体组分对气相氨平衡含量的影响,其值可在有关手册中查取。
如操作压力在 45 MPa以上,用水冷却即能使氨冷凝。操作压力在 20~30 MPa时,水冷仅能分出部分氨,气相中尚含氨 7%~9%,需进一步以液氨为冷冻剂冷却到 0℃以下,才能使气相中氨体积分数降至 2%~4%。
含氨混合气的冷却是在水冷却器和氨冷却器中实现的。冷冻用的液氨由冷冻循环供给,或为液氨产品的一部分。液氨在氨分离器中与气体分开,减压送入贮槽。贮槽压力一般为1.6~1.8 MPa。
液氨冷凝过程中,部分氮氢气及惰性气体溶解其中,溶解气大部分在液氨贮槽中减压释放出来,称之为“贮槽气”或“驰放气”。
气体在液氨中的溶解度,可按亨利定律近似计算。
②水吸收法。氨在水中有很大的溶解度,与溶液成平衡的气相氨分压很小。因而用水吸收法分离氨效果良好。但气相亦为水蒸气饱和,为防止催化剂中毒,循环气需严格脱除水分后进入合成塔。
水吸收法得到的产品是浓氨水。从浓氨水制取液氨须经过氨水蒸馏和气氨冷凝,消耗一定的能量,工业上采用此法者较少。近年来利用有机溶剂吸收氨的研究有所进展,它的优点是制取液氨时能耗少。
(2)合成氨流程
工业上氨的合成有多种流程,但总的包括以下基本步骤:
①净制的氢氮混合气由压缩机压缩到合成的压强;
②原料气经过最终净制;
③净化的原料气升温并合成;
④出口气体经冷冻系统分离出液氨,剩下的氢氮混合气用循环压缩机升压后重新导往合成;
⑤驰放部分循环气以维持气体中惰性气含量在规定值以下。
图 1.32 所示为凯洛格工艺合成氨流程。新鲜气在离心压缩机(15)的第一缸中压缩,经新鲜气甲烷化换热器(1)、水冷却器(2)及氨冷却器(3)逐步冷却到 8℃。在 4 中分离除去水分后,新鲜气进入压缩机第二缸继续压缩并与循环气在缸内混合,压力升到 15.5 MPa,温度为69℃,经过水冷却器(5),气体温度降至 38℃。然后气体分为两路,一路约 50%的气体经过两级串联的氨冷器(6)和(7),气体冷却至 10℃。另一路气体与高压氨分离器(12)来的-23℃的气体在冷热交换器(9)内换热,降温至-9℃,而来自高压氨分离器的冷气体则升温到 24℃。两路气体汇合后温度为-4℃。再经过氨冷器(8)将气体进一步冷却到-23℃,然后送往高压氨分离器(12)。分离液氨后含氨 2%的循环气经冷热交换器(9)和热交换热器(10)预热到 141℃进入轴向冷激式合成塔(13)。高压氨分离器(12)中的液氨经减压后进入低压氨分离器(11),液氨送去冷冻系统,从低压氨分离器内闪蒸出的驰放气与回收氨后的放空气一起送普里森氢回收系统。

图 1.32 凯洛格氨合成工艺
1—新鲜气甲烷化气换热器;2,5—水冷却器;3,6,7,8—氨冷却器;4—冷凝液分离器;9—冷热换热器;10—热热换热器;11—低压氨分离器;12—高压氨分离器;13—氨合成塔;14—锅炉给水预热器;15—离心压缩机;16—开工加热炉;17—放空气氨冷器;18—放空气分离器
该流程具有以下特点:采用离心式压缩机并回收合成氨的反应热预热锅炉给水;采用三级氨冷、三级闪蒸将 3 种不同压力的氨蒸汽分别返回离心式氨压缩机相应的压缩级中,这比全部氨气一次压缩至高压、冷凝后一次蒸发到同样压力的冷冻系数大,功耗少;放空管线位于压缩机循环段之前,此处惰性气体含量最高,但氨含量也最高,由于放空气经 17、18 可回收氨,故对氨损失影响不大;氨冷凝在压缩机循环段之后,能够进一步清除气体中夹带的密封油、二氧化碳等杂质,缺点是循环功耗较大。
图 1.33 是另一种合成氨的典型流程,称为托普索流程。与凯洛格流程比较,它在压缩机循环段前冷凝分离氨,循环功耗较低,但操作压力较高,仅采用二级氨冷。采用径向合成塔,系统压力减小,由于压力较高,对离心压缩机的要求提高。

图 1.33 托普索氨合成工艺流程
1—氨合成塔;2—锅炉给水预热器;3—热热交换器;4,11,12,13—水冷却器;5—冷热换热器;6—第一氨冷器;7—第二氨冷器;8,10—氨分离器;9—放空气氨冷;14,15,16—分离器;17—离心式压缩机;18—压缩机循环段
新鲜气经过三缸式离心机加压,每缸后均有水冷却器及分离器,以冷却加压后的气体并分出冷凝水,然后新鲜气与经过第一氨冷器的循环气混合通过第二氨冷器(7),温度降低到 0℃左右进入氨分离器(8)分出液氨,从氨分离器出来的气体中氨的体积分数约为 3.6%,通过冷热交换器(5)升温至 30℃,进入离心压缩机第三缸所带循环段补充压力,而后经预热进入径向冷激式合成塔(1)。出塔气体通过锅炉给水预热器(2)及各种换热器(3,4,5,6 等)温度降至 10℃左右与新鲜气混合,从而完成循环。
3)氨合成塔
(1)结构特点及基本要求
合成塔是氨合成过程的关键设备。随着技术的发展,合成塔的结构尺寸逐步大型化(表1.14)。并且对合成塔的性能,特别是运转的可靠性,提出了更严格的要求。总的说来,合成塔应满足以下要求:
①在正常操作条件下,反应维持自热;塔的结构要有利于升温、还原,保证催化剂有较大的生产强度。
②催化剂床层温度分布合理,充分利用催化剂的活性。
③气流在催化剂床层内分布均匀,塔的压降小。
④换热器传热强度大,体积小,高压容器空间利用率(催化剂体积/合成塔总容积)高。
⑤生产稳定,调节灵活,具有较大的操作弹性。
⑥结构简单可靠,各部件的连接与保温合理,内件在塔内有自由伸缩的余地以减少热应力。
表 1.14 合成塔结构尺寸的发展

在实施上述要求时,有时是矛盾的。合成塔设计就在于分清主次妥善解决这些矛盾。
为了结构合理,便于加工和检修方便等因素,合成塔分为筒体(外筒)和内件两部分。内件置入外筒之内,包括催化剂筐(触媒筐)、热交换器和电加热器 3 部分构成。大型氨合成塔的内件一般不设电加热器,而由塔外加热炉供热。进入合成塔的气体先经过内件与外筒之间的环隙,内件外面设有保温层,以减少向外筒的散热。因而外筒承受高压(操作压力与大气压力之差),但不承受高温,可用普通低合金钢或优质低碳钢制成,在正常情况下,寿命可达四五十年以上。内件虽在 500℃左右的高温下操作,但只承受环隙气流与内件气流的压差,一般仅1.0~2.0 MPa,从而可降低对材质的要求,一般内件可用合金钢制作。某些外筒内径在500 mm左右的合成塔,采用含碳量在 0.015%以下的微碳纯铁内件材料,也可满足生产上的要求。内件寿命比外件短,一般为 6~10 年。
合成塔大致分为连续换热式、多段间接换热式和多段冷激式 3 种塔型。目前常用的主要有冷管式和冷激式。前者属于连续换热式,后者属于多段冷激式。近年来将传统的塔内气流轴向流动改为径向流动以减小压力降,降低循环功耗而普遍受到了重视。
(2)冷管式合成塔
这一类型合成塔是在催化剂床层中设置换热管(冷管),管外是催化剂层,管内流过的是合成原料气。原料气吸收催化剂层中的反应热,使催化剂层维持在要求的温度,原料气体则被预热。冷管有单管、套管、U形管、并流和逆流等形式。我国常用的是并流三套管和并流单管式。
并流双套管合成塔的结构如图 1.34 所示。塔内部分分成两个区域,上半区是催化剂筐,下半部是热交换器。原料气分两路进入塔内,主路从合成塔的上侧进入,沿合成塔外筒内壁(1)与催化剂筐(2)之间的环隙顺流而下,保持合成塔筒体不致过热,筒体内壁上温度一般在40℃左右。之后气体进入下部换热器(3)的管间,与走管内的气体换热,换热后的净制气温度约为 350℃,经分气盒(6)下室流入催化剂筐内的冷却套管(4)的内管上升到顶部,再由内套管与外套管之间的空隙折流而下,进入分气盒(6)上室。在此过程中,混合气体与催化剂层气体并流换热(并流双套管由此得名),一方面降低催化剂层的温度,另一方面使本身进一步预热到 400℃左右。气体经分气盒(6)上室汇合后进入中心管(8),中心管内设电加热器(7)以备催化剂升温还原时补加热量。氢氮混合气在催化剂层中,在高温高压下进行合成,反应后的气体进入下部换热器(3)的管内,将热量传给管外的进塔气体,然后从塔底导出。

图 1.34 合成塔
1—外筒;2—催化剂;3—热交换器;4—冷却套管;5—热电偶管;6—分气盒;7—电加热器;8—中心管;9—冷气管
有少部分原料气作为副线,从合成塔下部进入,通过热交换器中央的冷气管直接与换热原料气汇合。必要时调节副线冷气量,可调节合成的温度。
并流三套管是由并流双套管演变而来,除催化剂筐的换热套管略有不同外,其他结构基本相同。三套管换热器(图1.35)的每支换热管由 3 根套管组成,内冷管与内衬管的末端焊住,使内冷管与内衬管间形成一层不流动的滞气层。气体通过内管时并不显著换热,直到气体从内冷管与外冷管的缝隙下流时才通过外冷管壁与催化剂层换热,其流向与气体通过催化剂层的方向相同。之后气体由中心管上升后分散与催化剂床层接触。催化剂层上端是一绝热反应层(此处无冷却套管),反应物升温很快,而后才与套管内的冷气换热。这时反应距平衡远,反应速度快,释放能量多;而换热器套管中的冷气温度较低,传热温差大,换热量多,使催化剂层温度不致过高。在催化剂床层下端,已有相当数量的氨生成,反应速率变慢,释出热量少,而冷气温度又已升高,传热温差减小,使传热与反应释放热量相适应。出催化剂床层的合成气再进入塔下部的热交换器,换热后送去冷却分氨。

图 1.35 并流三套管示意图
并流三套管合成塔的催化剂床层的温度和氨体积分数的变化如图 1.36 所示,其温度变化比双套管更趋近最适宜温度,虽然因套管体积稍大而使催化剂装填量减少,但氨产量还是提高了 5%~10%。另外,并流三套管还具有操作稳定、适应性强、结构可靠等优点;其缺点是结构复杂,冷管与分气盒占据较多的空间,催化剂还原时床层下部受冷管传热的影响升温困难,还原不易彻底。

图 1.36 三套管合成塔催化剂床层的温度变化和产物分布(压力 30 MPa,空速 25 700 h -1 ,冷管 32 根)(a)床层的温度;(b)气体通过床层时氨体积分数的变化
(3)冷激式合成塔
日产千吨以上的大型合成塔均采用冷激式设计。日产千吨的凯洛格四层轴向冷激式合成塔如图 1.37 所示。该塔外筒形状为上小下大的瓶式,在缩口部位密封,以便解决大塔径造成的密封困难。内件包括四层催化剂、层间气体混合装置(冷激管和挡板)以及列管式换热器。

图 1.37轴向冷激式氨合成塔
1—塔底封头接管;2—氧化铝球;3—筛板;4—人孔;5—冷激气接管;6—冷激管;7—下筒体;8—卸料管;9—中心管;10—催化剂筐;11—换热器;12—上筒体;13—波纹连接管
气体由塔底封头接管进入塔内,向上流经内外筒之环隙以冷却外筒。气体穿过催化剂筐缩口部分向上流过换热器(11)与上筒体(12)的环形空间,折流向下穿过换热器(11)的管间,被加热到 400℃左右入第一层催化剂,经反应后温度升至 500℃左右,在第一、二层间反应气与来自接管(5)的冷激气混合降温,而后进第二层催化剂。依此类推,最后气体由第四层催化剂层底部流出,而后折流向上穿过中心管(9)与换热器(11)的管内,换热后经波纹连接管(13)流出塔外。
在冷激式合成塔内,催化剂是多床层填放的,第一层因反应速率快而填放量较少,最末层最多。第一层催化剂保持在较高温度以争取反应速度,后几层在较低温度有利于氨达到较高体积分数。催化剂床层的温度和氨体积分数分布如图 1.38 所示。控制冷激气量可调节合成在最适宜温度附近进行。

图 1.38 冷激式合成塔催化剂床层的温度分布(凯洛格型,4 层,14 MPa,入口惰气为 13.6%,旧催化剂)
虽然床层越多,各床层的温度调节可以越灵敏,过程可以在越接近最适宜温度下进行,但床层到一定程度后有利因素并不多,例如 13 层比 4 层增产的氨量不到 1%,但结构变得极为复杂。工业冷激塔的催化剂层数,在操作压强为 15~17.5 MPa时,常设计为 4 层;17.5~22 MPa时,为 3 层;20 MPa以上,为 2~3 层。
与冷管式合成塔相比,冷激式合成塔的主要优缺点如表 1.15 所示。
表 1.15 冷激式合成塔的主要优缺点

上述各种塔中的气流方向是轴向的(自下而上或自上而下)。塔中的催化剂层有相当高度,如小型的 φ 25 内径的塔中,催化剂筐的内径和填充高度分别为 φ 375 mm和 2 180 mm,高径比约为 10,气流阻力很大。强化氨合成塔生产能力主要从两方面考虑:增大空间速度和提高净氨值。增大空间速度的同时还要求床层气流阻力不过大;提高净氨值则应使床层温度分布均匀并接近最适宜值,并且希望采用小粒度催化剂,而小粒度催化剂又会增大气流阻力。因此,轴向合成塔产量的提高受到一定限制。
径向催化剂筐合成塔如图 1.39 所示。原料气经换热后径向地由内向外(或从外向内)从中心管经催化剂床层向筒体与催化剂筐的缝隙处流动。径向合成塔主要有以下特点:
①气体通过催化剂床层的路径很短,通气截面积大,气流速度慢,气流阻力只有轴向的 10%~30%,从而可以提高空速,增大塔的生产能力。
②可采用小粒度(如 1.6~2.6 mm)催化剂,减少内扩散的影响,提高内表面利用率,从而提高净氨值。
③有利于催化剂的均匀还原,得到活性良好的催化剂(当催化剂在塔中)。
④降低了压强降,可适应离心压缩机使用的要求,降低动力消耗。

图 1.39 径向合成塔简图
在径向塔内,气体通过催化剂层时的流速是变化的,催化剂并不能被充分利用。由于气体流动的通道短,要求气流分布设计得均匀,因此,径向塔不适用于小型塔。
随着生产规模的扩大,合成氨厂自 20 世纪 60 年代中期以来,开始采用卧式氨合成塔,它不再需要高大厂房框架和大型起重安装设备,对基础没有特殊要求,并且像径向塔那样,有阻力降小的优点。卧式塔适用于大型厂,尤其是日产 1 500 t以上的氨合成厂。
4)氨合成过程的热能回收
氨合成反应的热效应
 = -46.22 kJ/mol,如产品为液氨,还有氨的冷凝热则生成液氨的热效应为-66.06 kJ/mol。实际上,上述能量并不能全部利用。为了回收热能,通常采用以下两种方法:一是用来加热锅炉给水,一是直接利用余热副产蒸汽。目前大型氨厂多采用前者,而一些中型氨厂多采用后者。如用于副产蒸汽,按废热锅炉安装的位置,又可分为两类:塔内副产蒸汽合成塔(内置式)和塔外副产蒸汽合成塔(外置式)。
= -46.22 kJ/mol,如产品为液氨,还有氨的冷凝热则生成液氨的热效应为-66.06 kJ/mol。实际上,上述能量并不能全部利用。为了回收热能,通常采用以下两种方法:一是用来加热锅炉给水,一是直接利用余热副产蒸汽。目前大型氨厂多采用前者,而一些中型氨厂多采用后者。如用于副产蒸汽,按废热锅炉安装的位置,又可分为两类:塔内副产蒸汽合成塔(内置式)和塔外副产蒸汽合成塔(外置式)。
内置式副产蒸汽合成塔,是在塔内几层催化剂层间设冷却盘管,高压循环水作载热体在锅炉与盘管间自然环流,高压循环水的压力与塔出口气体压力相等。此类塔型直接从催化剂床层取出热量,能产生较高压力的蒸汽,热能利用好,催化剂床层调温方便、稳定。但塔的结构复杂,冷却盘管易损坏,易漏水使催化剂而失效,所以目前已很少采用。
外置式副产蒸汽合成塔,根据反应气抽出位置的不同分为:前置式副产蒸汽合成塔,抽气位置在换热器之前,反应气出催化剂床层即入废热锅炉换热,然后回换热器,如图 1.40(a)所示,此法可产生 25~40 MPa的蒸汽。图 1.40(b)是中置式副产蒸汽合成塔,抽气位置在Ⅰ,Ⅱ换热器之间,由于气体温度较前置式低,可产生 1.3~1.5 MPa的蒸汽。图 1.40(c)是后置式副产蒸汽合成塔,抽气位置在换热器之后,可产生 0.4 MPa左右的低压蒸汽。
外置式与内置式比较,具有结构简单,附属设备少,制造检修方便等优点。但外置式塔直接从塔内移出一部分热量,为了维持自热,塔内换热器传热面积大(后置式除外),空速不能提高,因而催化剂生产强度较低,此外对材质的耐高温、耐腐蚀性能的要求也较高。大型合成氨厂一般采用预热锅炉给水的方法回收热能。此法与后置式废热锅炉相似,优点是锅炉给水预热后再由天然气蒸汽转化系统的高温废热产生 10 MPa的蒸汽,高压蒸汽使用价值高,这比合成系统自设废热锅炉生产低压蒸汽合理,并且设备简单,对材质要求较低,操作管理也容易。

图 1.40 外置式副产蒸汽合成塔示意图
 思考题
思考题
1.以天然气为原料合成氨的生产过程主要分为哪几个工序?
2.天然气水蒸气转化制合成气的主要反应有哪些?各反应的相态、反应热、转化率等有什么特点?如何用甲烷的转化率表示反应过程的组分组成?
3.天然气水蒸气转化制合成气的主要副反应有哪些?其危害是什么?抑制策略如何?
4.水蒸气转化过程的水碳比指的是什么?水碳比的选择需考虑哪些因素?
5.为什么采用两段转化?两段转化的供热方式各有什么不同?如何确定和控制二段转化的温度?
6.天然气中的硫成分有哪些?干法脱硫和湿法脱硫的主要方法有哪些?其适用范围有何区别?
7.氧化锌脱硫的工作原理是什么?其工艺流程和工艺条件如何?
8.改良ADA法脱硫的主要化学反应和脱硫原理是什么?吸收和再生的工艺流程和工艺条件如何?
9.CO变换工序的反应原理和主要任务是什么?为什么要分中温变换和低温变换?
10.说明中温变换和低温变换的温度、催化剂、出口CO含量。
11.气相色谱分析得变换前后合成气中CO的体积分率分别为 y 1 和 y 2 ,则变换率 x 如何表示?
12.苯菲尔脱碳的主要化学反应和脱碳原理是什么?再生指数(碳化度)的定义是什么?
13.苯菲尔脱碳流程中,吸收过程和再生过程的设备、温度、压力、再生指数各有什么特点?
14.甲烷化反应是水蒸气转化的逆反应,它们的反应条件和催化剂有什么不同?
15.高压氨合成反应式如下:

从上述催化平衡反应判断氨合成反应器的类型特点。
16.氨合成反应中,进口H 2 /N 2 比为 r ,如何用平衡NH 3 组成表示反应平衡常数?并从中分析温度、压力、 r 对反应平衡NH 3 含量的影响 。
17.什么是氨分解基流量,如何表示单程氨产率?
18.一氧化碳与水的变换反应为:
CO+H 2 O═CO 2 +H 2 +41.2 kJ/mol
混合原料气中H 2 O/CO的摩尔比为 2,在 500℃下的反应平衡常数为 4.88,反应后CO的转化率为多少?各组分的干基组成是多少?压力升高和降低温度对CO的转化率有什么影响?
19.某厂变换工段,变换前工艺气中CO体积分数为 13.56%,高温变换出口CO体积分数为 0.80%,低温变换出口CO体积分数为 0.26%,求高、低温变换率和总变换率?气体组成均为干基体积分率。
20.已知氨合成塔进口气量 22 000 h -1 (空速),装填催化剂 2.8 m 3 。进出塔气体中的氨体积分数分别为 2.7%和 20%,进塔惰性气体体积分数为 5%,氢氮比为 3。试计算:(1)催化剂的生产强度和合成塔年产量(8 000 h计);(2)出塔气体组成和气量。