





1.掌握 离心管、点滴板、表面皿、离心机等仪器的使用方法。
2.熟悉 利用气室法鉴定离子的操作。
3.练习 分离与鉴定的基本操作技术。
离子鉴定反应:大都是在水溶液中进行的离子反应,选择那些迅速而变化明显的反应,如溶液颜色的改变,沉淀的生成或溶解、气体的产生等。还要考虑反应的灵敏性和选择性。
NH 4 + 与碱作用生成NH 3 :NH 4 + +OH - =NH 3 ↑+H 2 O
生成的NH 3 气可在气室中用湿润的pH试纸检验。NH 3 气可使pH试纸显出碱性颜色。
离心机利用离心沉降原理将沉淀同溶液分开。
(一)主要实验仪器
离心管、离心机、表面皿、点滴板、胶头滴管。
(二)实验试剂
0.1mol/L FeCl 3 、0.1mol/L KSCN、0.1mol/L BaCl 2 、0.1mol/L K 2 CrO 4 、0.1mol/L NH 4 Cl、2mol/L NaOH、2mol/L HCl、pH试纸、蒸馏水、Fe 3+ 与Ba 2+ 混合液。
1.Fe 3+ 鉴定反应 在点滴板凹槽中,加入1滴0.1mol/L FeCl 3 溶液和1滴0.1mol/L KSCN溶液,观察溶液颜色变化。

2.Ba 2+ 鉴定反应 在点滴板凹槽中,加1滴NaAc以降低溶液的酸性, 加入1滴0.1mol/L BaCl 2 溶液和1滴0.1mol/L K 2 CrO 4 溶液,观察现象。
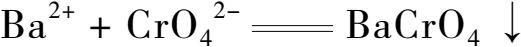
3.NH 4 + 的鉴定 气室法:将两滴0.1mol/L 氯化铵溶液一个表面皿凹处,再将润湿的pH试纸贴于另一只表面皿凹处。向装有溶液的表面皿中加一滴NaOH溶液,迅速将贴有试纸的表面皿倒扣其上。观察pH试纸变色情况。
4. Fe 3+ 、Ba 2+ 的分离与鉴定 在一支离心管中加入20滴Fe 3+ 、Ba 2+ 混合液,再加入5滴2mol/L NaOH溶液,有沉淀生成。

用离心机将沉淀与溶液分离。沿离心管壁加一滴NaOH溶液,观察上部清液是否变浑。如不变浑,表示沉淀以完全;否则继续滴加NaOH溶液,重新离心沉降。
用胶头滴管分出离心液,在离心液中滴加5滴K 2 CrO 4 溶液,若有黄色沉淀生成,表示有Ba 2+ 存在。在离心分离所得的沉淀中,逐滴加入HCl溶液,至沉淀完全溶解,再滴加5滴KSCN溶液,若溶液色变血红色,则表示有Fe 3+ 存在。

1.取用小滴瓶时,首先看清标签,严防张冠李戴。用完恢复原状。
2.离心机使用时,离心试管要对称放置,尽量使离心机对称位置上有质量相近的离心管。若只有一支样品管,另外一支要用等质量的水代替。
开动时应由慢速开始,运转平稳后再逐渐过渡到快速。停机,由快到慢。
1.鉴定反应具有的外部特征现象有哪些?
2.什么是特效反应?
(甘琳琳)