




 第二节
第二节
新生儿呼吸窘迫综合征(NRDS),又称新生儿肺透明膜病(HMD),由Avery和Mead于1959年首次命名,系指出生后不久出现呼吸窘迫并呈进行性加重的临床综合征。该病主要是由于肺泡表面活性物质(PS)不足导致进行性肺不张,病死率为早产儿疾病之首,属于新生儿科危重症,是重点监护和救治的疾病之一。据报道,出生体重1251~1500g的早产儿NRDS发病率约为56%,出生体重1001~1250g的早产儿NRDS发病率约为68%,出生体重751~1000g的早产儿NRDS发病率约为83%。近年来,对该病的研究较为深入,从预防到救治均取得了明显的进展,进而使该病的发病率和死亡率明显降低。
该病的发生主要是由于缺乏PS。PS主要由肺泡Ⅱ型上皮细胞产生,包括卵磷脂和磷脂酰甘油等。胎儿在胎龄22~24周时产生,量较少,随着胎龄增长,产生逐渐增多。胎龄24~30周时,糖皮质激素促进肺泡成熟的作用最大,也是产前预防本病的最佳阶段。胎龄35周以后,PS迅速进入肺泡表面,早产儿、宫内窘迫和出生时窒息的早产儿容易发生PS分泌偏低。
NRDS的病理特征为肺泡壁至终末细支气管壁上附有嗜伊红透明膜。电子显微镜下透明膜为无结构的薄膜,肺泡Ⅱ型上皮细胞细胞质内板层小体为空泡。
PS缺乏时肺泡塌陷,血流通过时不能进行正常的气血交换,形成肺内短路。同时氧合功能下降,使酸性物质增多,导致酸中毒,并造成血管渗透性增加,出现肺水肿。缺氧、酸中毒导致的肺水肿损伤肺部血管,NO产生减少,肺血管阻力增加,右心压力增加后导致动脉导管重新开放,血液由右向左分流,进入肺的血液减少,肺灌注不足,血管通透性增加,血浆内容物外渗,纤维蛋白等各种蛋白质沉积于损伤的肺组织,形成透明膜,严重妨碍气体交换,加重缺氧,形成恶性循环。
新生儿出生后4~6h内出现进行性呼吸困难,伴有呻吟、呼吸不规则或有呼吸暂停。血液由右向左分流时出现面色发绀,供氧也不能缓解。缺氧严重时,四肢肌张力低下,呼吸困难表现为鼻翼扇动、吸气性三凹征,以肋缘下端最为明显。听诊肺部呼吸音减低,吸气时可闻及细湿啰音。生存3d以上的新生儿恢复概率较大。该病也有轻型,起病较晚,可延迟至出生后24~48h,呼吸困难较轻,无呻吟,血液无右向左分流,3~4d后好转。
1.X线检查
NRDS早期两侧肺野透亮度普遍降低,可见均匀分布的细小颗粒和网状阴影;支气管有充气征,严重时肺不张扩大至整个肺部,肺野呈毛玻璃样病变,支气管充气征明显,肺野呈“白肺”。
2.血气分析
动脉血氧分压(PaO 2 )下降,动脉血二氧化碳分压(PaCO 2 )升高,pH降低。
3.识别标准
(1)出生后6h需要氧疗,直至24h。
(2)出生后24h内有临床表现。
(3)出生后24h需要呼吸支持,此时胸部X线检查异常与PS缺乏表现一致;或生后24h需要给予PS治疗。
维持血氧饱和度90%~95%,避免出生后血氧饱和度波动。轻症可用双鼻塞或面罩持续气道正压通气(CPAP)辅助通气,初始压力至少6cmH 2 O,此后根据病情、氧供及组织灌注情况予以调节。若吸入气中的氧浓度分数(FiO 2 )已达0.4,而动脉血氧分压(PaO 2 )仍低于6.65kPa,则需气管插管。早期应用加压辅助通气的早产儿大多可存活,存活72h以上且无严重并发症者常可产生足够的PS,病情逐渐好转。应用容量控制的呼吸机模式可缩短机械通气时间,减少支气管肺发育不良(BPD)的发生。必要时可采用高频振荡通气(HFOV)进行呼吸支持。撤机时允许存在中等程度的高碳酸血症(血pH须维持在7.22以上),避免低碳酸血症,以免增加脑室内出血(IVH)的风险。
PS已成为NRDS的常规治疗手段,天然PS的初始剂量为200mg/kg,每隔8~12h可重复使用,重复剂量为每次100mg/kg,最大总剂量为300~400mg/kg。有研究表明,与使用单剂PS相比,用至3剂可降低死亡率及肺气漏发生率,重复使用应≤4次。给予PS后应迅速下调氧浓度,避免高氧峰值。若较为成熟的早产儿使用气管插管,应根据早产儿耐受情况采用CPAP或经鼻间歇正压通气(NIPPV)辅助通气。CPAP联合早期PS治疗被认为是治疗NRDS的最佳方法。
注意保暖,保持适宜的温度,减少氧耗。维持营养和水、电解质平衡。保湿暖箱中的早产儿静脉补液起始剂量为70~80ml/(kg·d)。早产儿的水、电解质治疗应个体化,出生后最初5d应允许体重每日下降2.5%~4%(共计15%)。出生后前几天限制钠摄入,尿量增加后方可补钠。严密监测液体平衡和电解质情况。
当有组织灌注不良时,应进行针对性低血压治疗。若无心功能不全,首选生理盐水10~20ml/kg进行扩容治疗。如果扩容提升血压效果不佳,可考虑使用多巴胺2~20μg/(kg·min)。若存在全身低血容量和心功能不全,多巴酚丁胺5~20μg/(kg·min)和肾上腺素0.01~1.0μg/(kg·min)可分别作为一线和二线治疗药物。常规治疗无效的难治性低血压可考虑给予氢化可的松1mg/kg,每8h 1次。
(1)咖啡因:用于有呼吸暂停者或促进撤机,对于存在上机高危因素者,如进行无创呼吸支持的出生体重<1250g的早产儿,应考虑使用咖啡因。
(2)地塞米松:对于出生1~2周后仍需机械通气的早产儿,可以采用短期、逐渐减量的低剂量或极低剂量地塞米松治疗,以促进尽早拔管。
(3)抗感染药物:使用抗生素直至排除败血症,常用青霉素或氨苄西林联合氨基糖苷类。若早产儿在侵入性真菌感染率较高的病房,可以预防性使用抗真菌药,如氟康唑。
出生后第1周维持血红蛋白在12g/dl,第2周在11g/dl,第2周以后在9g/dl。给予布洛芬或吲哚美辛以促进动脉导管关闭。
放置鼻塞时,先清除呼吸道及口腔分泌物,清洁鼻腔。鼻部采用人工皮保护鼻部皮肤和鼻中隔。经常检查装置各连接处是否严密,有无漏气。吸痰时取下鼻塞,检查鼻部有无压迫引起的皮肤坏死或鼻中隔破损等。每小时观察CPAP压力和氧浓度,氧浓度根据情况逐步下调,当压力<4cmH 2 O、氧浓度<21%时,需考虑是否试停CPAP。
吸入的氧气应加温湿化。及时清除呼吸道分泌物,按需吸痰。吸痰时严格遵守无菌操作原则,动作轻柔、敏捷,每次吸痰时间不超过15s,压力8~13.3kPa,防止损伤呼吸道黏膜,影响呼吸。另外,应注意观察痰液的性状及量。若痰稀少,可适当减少吸痰次数;痰多且黏稠时,予以雾化吸入,适当增加吸痰次数。
采用经口或经鼻插管法时,应妥善固定气管插管,避免脱管,护士每个班次应测量并记录置管长度。检查接头有无松脱漏气、管道有无扭转受压。湿化器内盛蒸馏水至标准线刻度处,吸入气体用注射用水加温湿化,使吸入气体温度为32~35℃,以保护呼吸道黏膜,稀释分泌物,进而利于分泌物排出。每次吸痰操作前后注意导管位置固定是否正确,听诊肺部呼吸音是否对称,记录吸痰时间、痰量、性状和颜色,必要时送检做痰液培养。
通常于出生后24h内给药,采用滴入法(气管插管或喉罩)或雾化吸入给药。给药步骤:①用药前彻底清除口、鼻腔及气道内的分泌物;②仰卧位,头置于正中;③给药时可与呼吸机相连,也可暂时断开;④将PS置于暖箱内或握在手中数分钟进行预热,摇匀时不可太剧烈,以免产生泡沫;⑤确定给药导管长度,给药导管应比气管内导管短1cm,确保药液能到达气管内导管末端;⑥将给药导管置入气管导管内,将PS稳定推入给药导管内;⑦注入PS后,予以复苏气囊加压通气1min,然后接呼吸机辅助通气。注药期间严密监测PaO 2 、血氧饱和度、心率、呼吸和血压变化。若出现呼吸暂停或PaO 2 及心率下降,应暂停注药,迅速给予复苏囊加压给氧,注意压力不可过大以免发生气胸,直至恢复稳定状态。重新注药时,要确定气管插管位置正确后再操作,使用后须记录PS批号。使用呼吸机辅助通气者在使用PS后须将呼吸机参数适当下调,PS注入后6h内勿翻身拍背和吸痰,床头设醒目提示卡,严格进行交接班,密切观察病情,注意有无颅内出血的早期表现。
如果病情允许,应在出生后第1天开始微量喂养,遵医嘱予以肠外营养,采用经外周静脉置入中心静脉导管(PICC)输入静脉营养液,微量注射泵控制输入速度。加强巡视,防止营养液渗出而引起皮肤坏死。
尽量减少常规操作以避免造成医源性缺氧。实施袋鼠式护理建立亲子联系。维持体温在36.5~37.5℃,维持暖箱湿度在60%~80%,以减少不显性失水。
观察呼吸运动、呼吸频率、肤色、血氧饱和度、组织灌注情况、血压、胸廓运动,监测血气分析、血糖、血细胞比容、尿量、尿素氮、肌酐等,每12~24h测定Na
+
、K
+
、Cl
-
。至少每4h测定1次pH、PaO
2
、PaCO
2
、
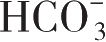 。
。
Silverman Anderson(SA)评分(表1-1)简便易行、实用,能客观反映呼吸窘迫的严重程度,有利于在床边快速评估病情,及时做出正确处理,提高NRDS的救治质量。
表1-1 Silverman Anderson评分

评分越高,呼吸窘迫越严重;评分大于6分,提示处于呼吸衰竭的临界状态。2013年版欧洲早产儿呼吸窘迫综合征管理共识指南推荐见表1-2。
表1-2 2013年版欧洲早产儿呼吸窘迫综合征管理共识指南推荐

续表
