




2001 TBS系统(the bethesda system)是国际统一的宫颈细胞学诊断标准指南。根据这个系统,宫颈细胞学的报告应包括:样本的种类,如阴道样本还是宫颈样本;样本合格性的评判;诊断分类以及描述性判读用语;是否机器自动阅片及结果;是否有辅助检查,如HPV测定及其结果。应用2001 TBS系统,有助于统一报告用语和细则,增进病理科医生和临床医生的沟通,协助临床医生对患者做出恰当的诊断及正确的处理。
2001 TBS系统
样本类别
标明传统涂片(巴氏涂片)、液基制片或其他类别
样本质量评估
□ 阅片满意(说明有无子宫颈管/移行区成分及任何其他质量的指标,如:部分血涂片、炎症等)
□ 阅片不满意(注明原因)
□ 样本拒收/未进入制片过程(说明理由)
□ 样本经制片并进行阅片,但对判读上皮细胞异常不满意(说明原因)
总体分类(任选,是否报告自行决定)
□ 无上皮内病变或恶性病变
□ 其他:见判读意见/结果(例如:≥40岁妇女涂片中有子宫内膜细胞)
□ 上皮细胞异常:见判读意见/结果(注明“鳞状上皮”或“腺上皮”)
判读意见/结果
无上皮内病变或恶性病变〔若无肿瘤性细胞,需在报告栏的判读意见/结果之上和(或)其内的总体分类中表述,不管有无微生物病原体或其他非肿瘤性变化〕
微生物病原体
△ 滴虫
△ 形态符合白色念珠菌
△ 菌群失调,提示细菌性阴道病
△ 形态符合放线菌的细菌
△ 符合单纯疱疹病毒的细胞学改变
其他非肿瘤性改变(是否报告任选,不列入表内)
△ 反应性细胞变化,见于
△ 子宫切除后是否有腺细胞
△ 萎缩
其他
△ 子宫内膜细胞(见于≥40岁的妇女)
(如“无鳞状上皮内病变”需说明)
上皮细胞异常
鳞状细胞
△ 非典型鳞状细胞
△ 低度鳞状上皮内病变(LSIL)(包括:HPV/轻度异型增生/CIN 1)
△ 高度鳞状上皮内病变(HSIL)(包括:中度及重度异型增生;CIN 2及CIN 3)
△ 鳞状细胞癌(SCC)
腺细胞
△ 非典型腺细胞(AGC)
△ 非典型腺细胞
△ 子宫颈管原位腺癌(AIS)
△ 腺癌
其他恶性肿瘤(需具体说明)
辅助性检测
简要说明检测方法并报告其结果,便于临床医生了解。
自动阅片
若经自动仪器检阅,需要说明仪器类别并报告其结果。
教育注释及建议(任选)
建议内容应确切,并与专业人员组织出版的临床随访原则相一致,可包括参阅出版的出版物。
1. 样本质量的评判
TBS分为两部分:
(1)满意样本:同时描述有或无子宫颈管/移行区成分。(图7-1~7-8)
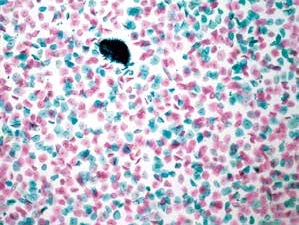
图7-1 满意样本(低倍、液基、巴氏染色)
低倍一个4×视野细胞数量足够多,液基制片鳞状上皮细胞数量超过5 000个。并可见到子宫颈管腺细胞。
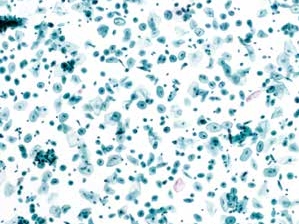
图7-2 满意样本(中倍、液基、巴氏染色)
绝经样本,一个中倍视野细胞数量足够多,液基制片鳞状细胞数量超过5 000个以上。染色良好。
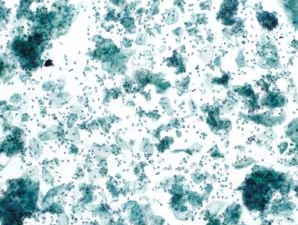
图7-3 满意样本(低倍、液基、巴氏染色)
妊娠期样本,雌激素水平低下,细胞蓝染。
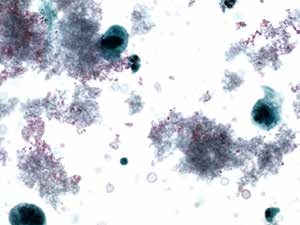
图7-4 满意样本(高倍、液基、巴氏染色)
任何存在异常细胞的样本均属合格样本。即便细胞数量少,制片不满意,但只要发现一个异常细胞,也报告为满意样本。
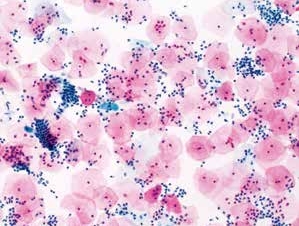
图7-5 满意样本(中倍、液基、巴氏染色)
正常子宫颈管腺细胞,蜂窝状排列,足够数量的鳞状上皮细胞,炎细胞背景。
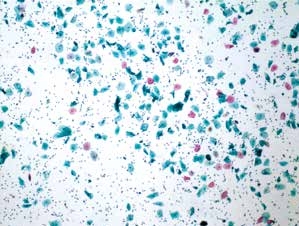
图7-6 满意样本(低倍、液基、巴氏染色)
足够数量的鳞状上皮细胞,炎细胞背景。
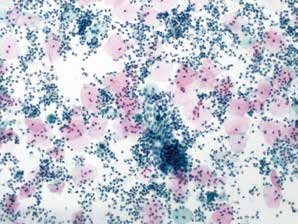
图7-7 满意样本(中倍、液基、巴氏染色)
子宫颈管腺细胞、足够数量的鳞状上皮细胞以及大量的炎细胞。此例判读为NILM,报告中应注明可见大量的炎细胞。
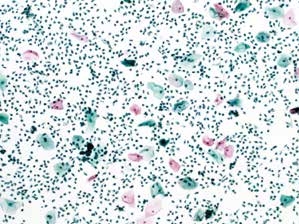
图7-8 满意样本(低倍、液基、巴氏染色)
鳞状上皮细胞的数量约为5 000个,背景中大量的炎细胞。满意样本的临界状态。
(2)不满意样本:① 拒收样本,如无姓名样本以及玻璃片破碎等。② 人为因素或样本条件受限而无法判读。如血液或炎细胞覆盖过多,超过75%的鳞状上皮细胞被遮盖判读为不满意样本。计算被遮盖细胞的百分数,而不是被遮盖涂片的面积。③ 鳞状细胞数量过少(传统涂片小于8 000个鳞状上皮细胞;液基制片小于5 000个鳞状上皮细胞)。(图7-9~7-13)
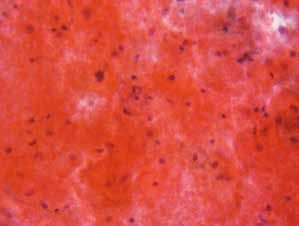
图7-9 不满意样本(中倍、液基、巴氏染色)
鳞状上皮细胞被血液遮盖,无法看清楚。
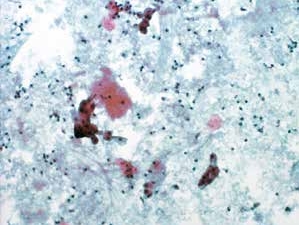
图7-10 不满意样本(中倍、液基、巴氏染色)
背景血性污浊,细胞散在,细胞量过少。
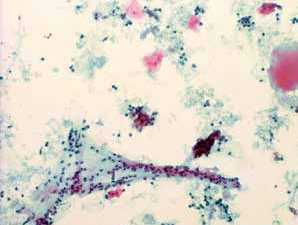
图7-11 不满意样本(中倍、液基、巴氏染色)
炎性背景,鳞状上皮数量极少。需要重新制片,或者重新取样后再制片。
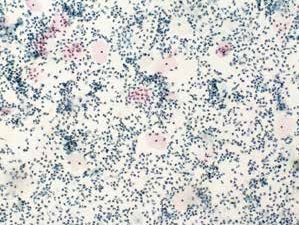
图7-12 不满意样本(低倍、液基、巴氏染色)
炎细胞大量,鳞状上皮细胞少量。鳞状上皮细胞数量不足5 000个,需要重新制片。
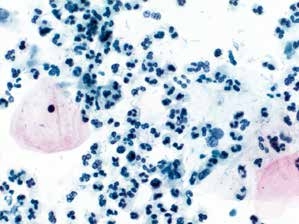
图7-13 不满意样本(高倍、液基、巴氏染色)
高倍显示大量中性粒细胞,此例无足够数量的鳞状上皮细胞,但仍需报告可见大量的炎细胞。
要强调的是,任何存在异常细胞(非典型鳞状细胞、非典型腺细胞以及更严重病变)的样本均属于合格样本;不满意样本一定要更加慎重对待,相当一部分不满意样本在重复制片或重复取样后再制片可发现鳞状上皮内病变(SIL/Ca)。
2. 满意样本所含鳞状上皮细胞最低数量的标准
(1)传统涂片:一张涂片要有8 000~12 000个细胞核保存完好并且结构清晰的鳞状上皮细胞。显微镜下的评判,可用4×的视野观察,每个视野有1 000个细胞,每张涂片至少应有8个这样的4×视野;也可用40×视野,每个视野至少有10个细胞,计算10个这样的视野。
(2)液基制片:每张制片至少应有5 000个细胞核保存完好并且结构清晰的鳞状上皮细胞。粗略计算可用40×视野,每个视野约4个细胞,计算至少10个连续的视野。
强调说明:① 这个最低数量标准仅限于鳞状上皮细胞,鳞状化生细胞也可以算为鳞状上皮细胞,排除子宫颈管腺细胞和被遮盖的看不清楚的鳞状上皮细胞。② 如果细胞数量过少需要找出原因重新制片,最低数量标准是指一张满意涂片的标准,而不是将几张重新制片的鳞状细胞数量累加。③ 最低数量标准只适用于子宫颈细胞学样本,对于阴道取样或者全子宫切除术后的样本,即便出现细胞数量偏低的情况,也可以接受认可。
3. 子宫颈管/移行区成分的几点说明(图7-14~7-18)
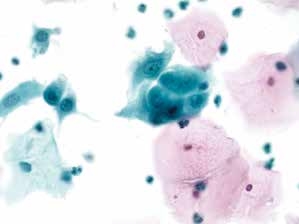
图7-14 子宫颈管/移行区成分的几点说明(高倍、液基、巴氏染色)
每张片至少应有10个单独或成团,形态完整且保存完好的子宫颈管腺细胞或鳞状化生细胞。图示鳞状化生细胞。
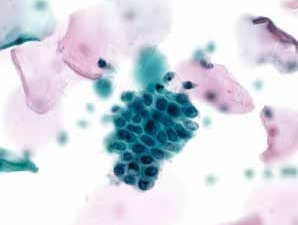
图7-15 子宫颈管/移行区成分的几点说明(高倍、液基、巴氏染色)
每张片至少应有10个单独或成团,形态完整且保存完好的子宫颈管腺细胞或鳞状化生细胞。图示子宫颈管腺细胞。
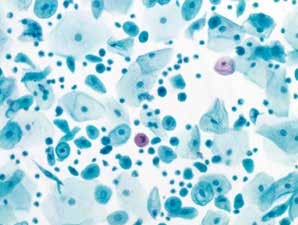
图7-16 子宫颈管/移行区成分的几点说明(中倍、液基、巴氏染色)
萎缩性改变(绝经、产后、孕激素作用)不必报移行区,但应注明为萎缩性改变。此例为绝经萎缩性改变。
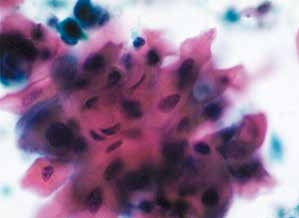
图7-17 子宫颈管/移行区成分的几点说明(高倍、液基、巴氏染色)
查见异常细胞,可以不报告移行区的改变。图示为鳞状细胞癌。
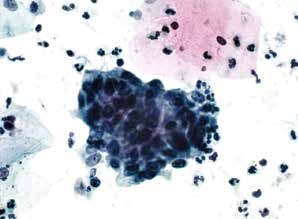
图7-18 子宫颈管/移行区成分的几点说明(高倍、液基、巴氏染色)
低度或高度鳞状上皮内病变,可以不报告移行区的改变。图示高度鳞状上皮内病变。
(1)传统涂片以及液基制片,每张片至少应有10个单个或成团形态完整且保存完好的子宫颈管腺细胞或鳞状化生细胞。
(2)下列情况不需要报移行区的存在:子宫全切术后妇女、低度鳞状上皮内病变、高度鳞状上皮内病变或癌。
(3)萎缩性改变(如绝经、产后、孕激素作用),不必报移行区,但应说明是萎缩性改变。
缩写一览表
1. Cervical Cytopathology Practice Guidelines. American Society of Cytopathology. Acta Cytol, 2001, 45:201-226.
2. Diane Solomon, Ritu Nayar. The Bethesda System for Reporting Cervical Cytology. Second Edition. Springer, 2003.
3. DeMay RM. The Art and Science of Cytopathology. Chicago: ASCP Press, 1996.
4. Edmund S. Cibas, Cytology—Diagnostic Principles and Clinical Correlates. Second Edition. Saunders, 2007.
5. The 2001 Bethesda System. web site: http://nih.techriver.net/.
注:低倍,<20×;中倍,20×;高倍,>20×。