




根据TBS 2001,鳞状上皮细胞异常分为:非典型鳞状细胞(ASC)、低度鳞状上皮内病变(LSIL)、高度鳞状上皮内病变(HSIL)及鳞状细胞癌(SCC)。LSIL等同于CIN 1、HPV感染引起的细胞学改变;HSIL等同于CIN 2、CIN 3及原位癌(CIS)。
如何识别鳞状上皮细胞异常?主要根据细胞核的改变,细胞核“大及黑”则为异常。细胞核面积比中间层上皮细胞核增大3倍以上(ASC-H细胞核增大稍小一些),且染色质明显加深则为异常细胞。
异常程度如何判读,LSIL还是HSIL?主要根据核质比的改变。随着核质比的增高,异常程度越高;LSIL细胞核异常,但胞质很丰富,核质比稍增大;HSIL细胞核异常,胞质明显减少,核质比明显增高。HSIL细胞有时胞质边界不清,无法区别各自的胞质,仅见一堆异型核聚集成团。
总之,根据细胞核的异常可判断细胞的异常,核质比的异常决定鳞状上皮内病变的程度。
ASC指鳞状上皮细胞的异常改变提示可能为LSIL,或为不能确定级别的SIL,但无论从质量还是数量均不足以做出明确诊断。ASC包括与致瘤型HPV感染无关的改变或瘤变,也包括可能潜在的宫颈上皮内瘤变(CIN),以及极少数的癌。
有资料显示约50%ASC患者有高危型HPV感染,许多与HPV感染无关的非肿瘤性改变也能产生类似ASC的细胞学改变,如炎症、萎缩性改变、取样固定及制片中的人为假象。
TBS 2001中的ASC包括两个内容:
(1)非典型鳞状细胞,意义不明确(atypical squamous cells-underdertermined significance, ASC-US)。
(2)非典型鳞状细胞,不除外高度鳞状上皮内病变(atypical squamous cells-cannot exclude HSIL, ASC-H)。
在大多数实验室,ASC-US约占ASC的90%以上,ASC-H仅占ASC的10%以下。需要注意不应随意滥用ASC,ASC在总体样本中不应占较大比例,有的实验室控制在3%以下。
ASC-US细胞形态特征:重点观察细胞核的形态异常,细胞核增大,大小为正常中间层鳞状细胞核的2.5~3.0倍,可呈双核或多核,核质比轻度增高,染色质轻度加深,但均匀分布。胞核形状与核膜不规则,胞质较多或有角化。(图4-1~4-6)
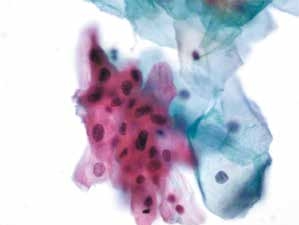
图4-1 非典型鳞状细胞,意义不明确(ASC-US)(高倍、液基、巴氏染色)
表层鳞状上皮细胞成片,细胞核增大,形状略不规则,核质比轻度增高。
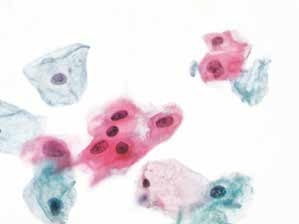
图4-2 非典型鳞状细胞,意义不明确(ASC-US)(高倍、液基、巴氏染色)
细胞核略增大(与中层鳞状上皮细胞核相比),形状略不规则,染色质稍深染,颗粒微粗。
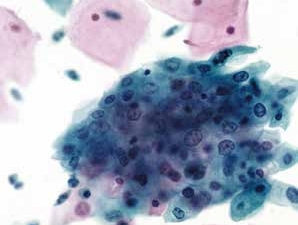
图4-3 非典型鳞状细胞,意义不明确(ASC-US)(高倍、液基、巴氏染色)
鳞状上皮细胞核轻度增加,染色质略深染,颗粒微粗,胞质仍多,核质比轻度增高。
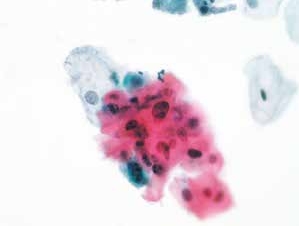
图4-4 非典型鳞状细胞,意义不明确(ASC-US)(高倍、液基、巴氏染色)
个别鳞状上皮细胞核增大,核质比轻度增高,染色质轻度深染,颗粒微粗。
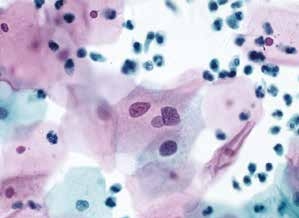
图4-5 非典型鳞状细胞,意义不明确(ASC-US)(高倍、液基、巴氏染色)
细胞核增大,为正常中层鳞状上皮细胞核的2.5~3.0倍,胞核轻度异型。
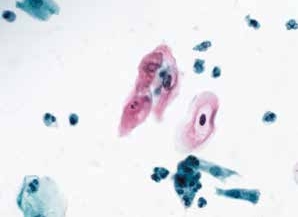
图4-6 非典型鳞状细胞,意义不明确(ASC-US)(高倍、液基、巴氏染色)
成熟的表层鳞状上皮细胞,胞核增大不明显,但核周明显“挖空现象”,疑为HPV感染。可诊断为ASC-US。
鉴别诊断:鳞状化生细胞、角化不全的鳞状上皮细胞、炎性改变、萎缩性改变、人为假象(取材、固定、制片等环节)、变性的子宫内膜腺细胞以及组织细胞。
ASC-H细胞形态特征:重点依然观察细胞核的形态异常,细胞核增大,大小为正常中间层鳞状细胞核1.5~2.5倍,染色质稍深染,核质比增高。单个或成片,不规则排列,细胞数量常较少。胞质较少,浓稠或角化。液基制片部分细胞为单个的副基底样小细胞,极易被忽略。(图4-7~4-9)
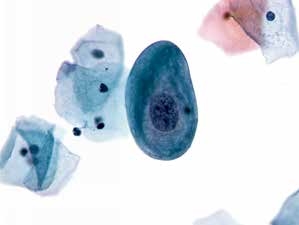
图4-7 非典型鳞状细胞,意义不明确(高倍、液基、巴氏染色)
此例仅查见一个异型细胞,细胞特征符合LSIL。但因数量太少,可报告为ASC-US。
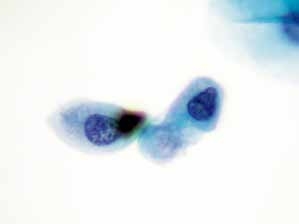
图4-8 非典型鳞状细胞,不除外高度鳞状上皮内病变(ASC-H)(高倍、液基、巴氏染色)
单个的异型细胞,胞核增大,核膜不光滑,核质比明显增加,判读ASC-H,随访为高度鳞状上皮内病变。
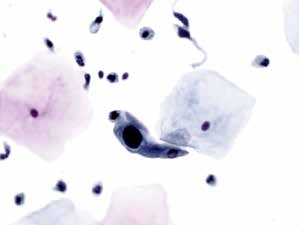
图4-9 非典型鳞状细胞,不除外高度鳞状上皮内病变(ASC-H)(高倍、液基、巴氏染色)
背景干净,细胞核明显增大,染色深,胞质少,核质比明显增高,因单个出现,数量少,可诊断为ASC-H或HSIL。
LSIL由各种高危型或低危型HPV感染所致,包括HPV感染引起的细胞形态改变(挖空细胞)和轻度异型增生细胞(非挖空细胞)。这两种病变感染的HPV类型相似,其生物学行为、临床治疗及随访也相近,因此对“HPV感染”已不再另外诊断,将它们归为低度鳞状上皮内病变(LSIL)和CIN 1。
细胞形态特征(图4-10~4-30)
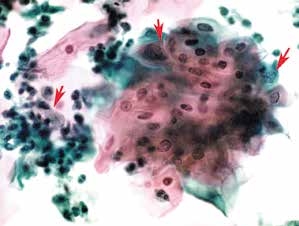
图4-10 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
细胞成片,大小形态不规则,胞核异型性明显。右上两个箭头为受累的鳞状上皮细胞,左箭头为反应性子宫颈管腺细胞。
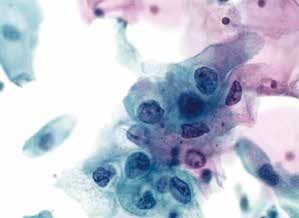
图4-11 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
细胞核增大,异型性明显,核膜不规则,染色质增粗,核质比明显增高。
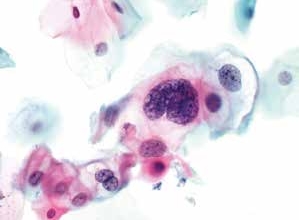
图4-12 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
双核及多核细胞,细胞核明显增大,染色质粗颗粒,胞核异型性明显,见核周空腔。
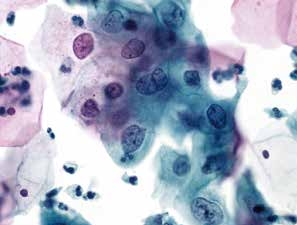
图4-13 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
中层及表层鳞状上皮细胞,胞核明显增大,核膜不规则,胞质分化成熟。
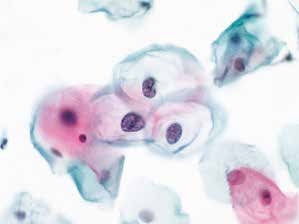
图4-14 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
细胞核增大,核膜轻度不规则,明显核周空腔,典型挖空细胞。
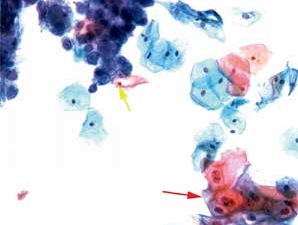
图4-15 低度鳞状上皮内病变(LSIL)合并单纯疱疹病毒感染(HSV)(高倍、液基、巴氏染色)
细胞核增大,异型性明显,核周空腔,为典型的挖空细胞(红箭头)。同时还可见疱疹病毒感染而导致的细胞改变(黄箭头)。此例为LSIL合并HSV感染。
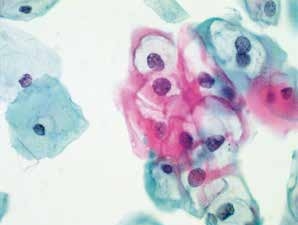
图4-16 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
典型挖空细胞,核周空腔界限清晰,周围胞质增厚,宽窄不均匀,细胞核增大异型,符合LSIL改变。
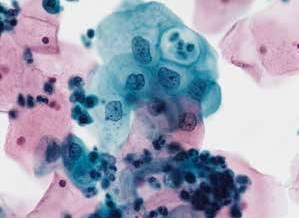
图4-17 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
细胞核明显增大,超过正常中层鳞状上皮细胞核3.0~4.0倍以上,胞核异型,染色质分布均匀,胞质分化成熟。
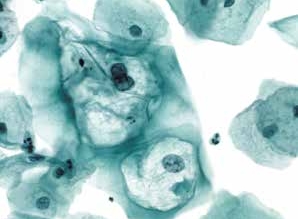
图4-18 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
挖空细胞,单核和双核细胞。细胞核及胞质的改变均符合LSIL诊断标准。
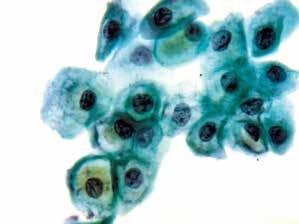
图4-19 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
挖空细胞,细胞核异型性明显,核质比增加。诊断LSIL细胞核必须具有异型性,仅有胞质的改变不足以诊断。
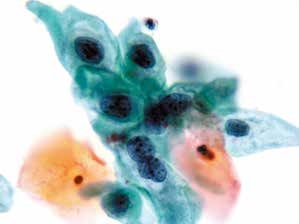
图4-20 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
单核及双核细胞均增大,核膜不规则,染色质粗糙,胞质丰富,核质比增加。
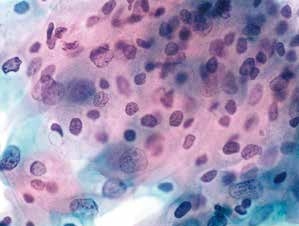
图4-21 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
表层及少许中层成熟鳞状上皮细胞,细胞核明显异型,数量及质量均达到LSIL诊断标准。
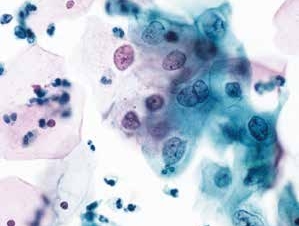
图4-22 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
表层及中层成熟鳞状上皮细胞。胞核增大,核膜不规则,染色质略粗,均匀分布,胞质丰富。
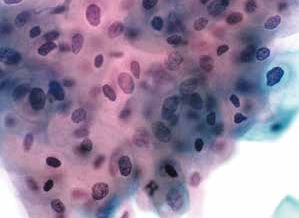
图4-23 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
成熟鳞状上皮细胞大小不一,核膜不规则,染色深,胞质丰富。符合LSIL改变。
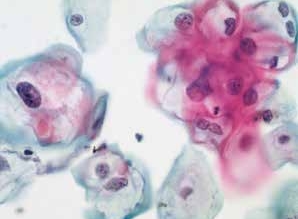
图4-24 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
典型挖空细胞,核周空腔,周围胞质增厚,宽窄不均。细胞核明显异型,可见双核细胞。
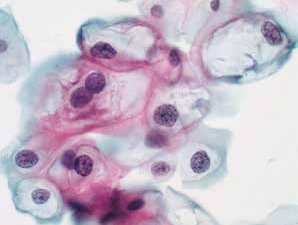
图4-25 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
细胞核增大,核膜不规则,核质比增高。明显的核周空腔,典型的挖空细胞。
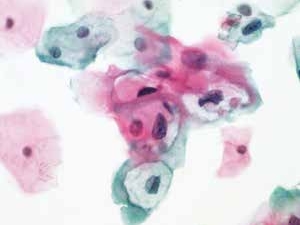
图4-26 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
细胞核异型性明显,核膜不规则。核周空腔,典型的挖空细胞。
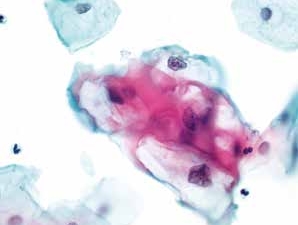
图4-27 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
挖空细胞是HPV感染的特征性表现,但不是诊断LSIL的必要条件,必须具有细胞核的异型性,才可以诊断LSIL。此图胞核与胞质均符合典型LSIL改变。
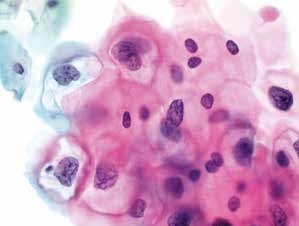
图4-28 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
典型的挖空细胞。细胞核增大,明显异型性,核膜不规则,染色质粗糙,可见双核。
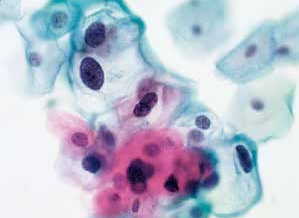
图4-29 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
核周空腔明显,典型的挖空细胞。注意观察细胞核的异型性改变。
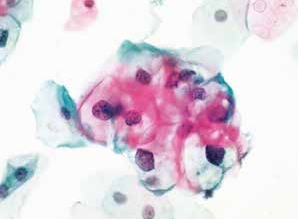
图4-30 低度鳞状上皮内病变(LSIL)(高倍、液基、巴氏染色)
细胞核增大深染,异型性明显。核周空腔,典型的挖空细胞。
(1)细胞排列:常成团或片状排列,也可单个散在。
(2)细胞形态:细胞增大而异型。
(3)细胞核:明显增大,大小为正常中层鳞状上皮细胞核3倍以上,可见双核和多核,染色质粗糙,染色加深,分布均匀,核仁不明显,核膜光滑或轻度不规则。还可见小角化细胞(角化不全),胞核多固缩。
(4)细胞质:丰富而成熟,多角形,边界清楚。核周空腔,即由边界清楚的核周透亮区及胞质边缘浓染区组成,这种特殊形态的细胞称为挖空细胞。挖空细胞是LSIL的特征性表现,但不是诊断的必要条件,挖空细胞必须具有胞核的异常才能诊断LSIL。
诊断的关键:胞核增大,大小约为正常中间层鳞状上皮细胞核的3倍以上(实际工作中也会遇到典型的挖空细胞,明显的胞核异型性,但其细胞核仅比中间层鳞状上皮细胞核轻度增大)。胞核异型性明显,深染,染色质分布均匀;胞质成熟,中层或表层鳞状上皮细胞的胞质。
鉴别诊断:某些感染如真菌、滴虫等,上皮细胞也可出现类似于挖空细胞的核周空腔现象。区别的关键是LSIL必须具有明显的细胞核异型性。
HSIL通常为不成熟的鳞状上皮细胞病变。
细胞形态特征(图4-31~4-49)
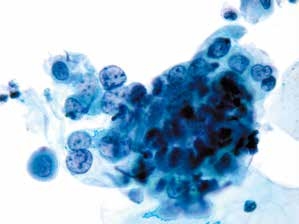
图4-31 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
异型增生的细胞密集成团,胞核明显增大,核膜不规则,核质比明显增高。
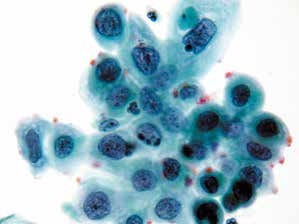
图4-32 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞核异型性明显,染色质粗颗粒状,核膜不规则,胞质浓染,核质比高。此为异型性明显的不成熟化生细胞,判读为HSIL。
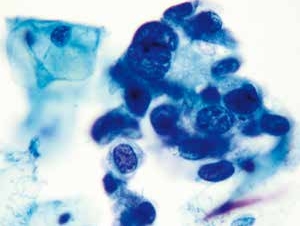
图4-33 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞核异型性明显,核质比高,染色质粗颗粒状,核膜不规则,淡染的胞质。
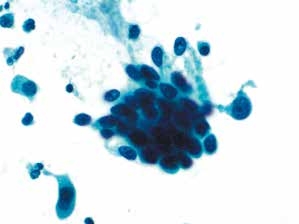
图4-34 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞片状密集排列,胞核深染,染色质粗糙,高核质比,胞质少,背景干净。
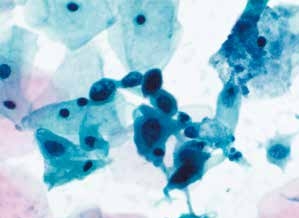
图4-35 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞核增大深染,染色质粗糙,核膜不规则,核质比高。
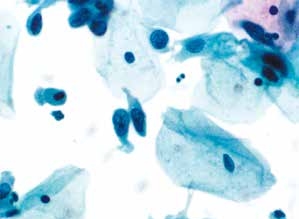
图4-36 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞散在分布,胞核增大深染,核膜不规则,核质比高,符合HSIL改变。
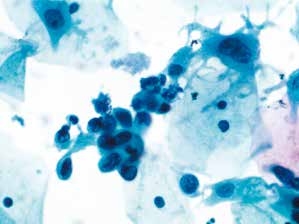
图4-37 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞异型性明显,胞核增大深染,核膜明显不规则,核质比高,符合HSIL改变。
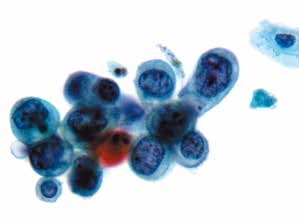
图4-38 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞核异型性明显,核膜不规则,染色质粗糙,不均匀分布,核质比高。
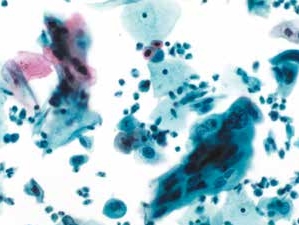
图4-39 高度鳞状上皮内病变(HSIL)(中倍、液基、巴氏染色)
细胞大小形状不一,排列紧密,胞核拉长。背景散在单个高核质比的细胞以及炎性细胞。
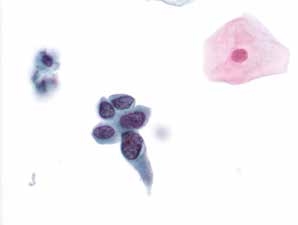
图4-40 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞核大小形状异常,核膜不规则,染色质粗糙,核质比高。
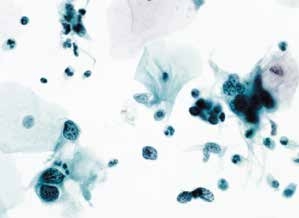
图4-41 高度鳞状上皮内病变(HSIL)(中倍、液基、巴氏染色)
细胞核异型,核膜不规则,染色质粗颗粒,分布异常,可见裸核,背景散在炎细胞。
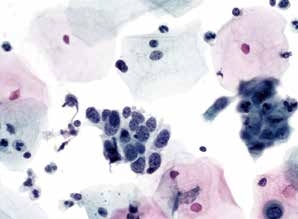
图4-42 高度鳞状上皮内病变(HSIL)(中倍、液基、巴氏染色)
视野中央细胞核增大,细胞较小,核膜不规则,胞质少,核质比高。符合HSIL改变。
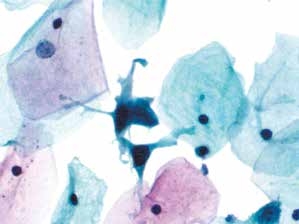
图4-43 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
化生细胞有异型性,胞核增大深染,核膜不规则。显微镜下其他视野发现多量类似的细胞。符合HSIL改变。
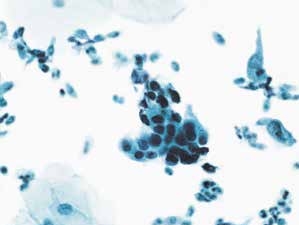
图4-44 高度鳞状上皮内病变(HSIL)(中倍、液基、巴氏染色)
细胞核大小与中层鳞状上皮细胞比较接近,但细胞有异型性,胞核深染,核质比较高。符合HSIL改变。
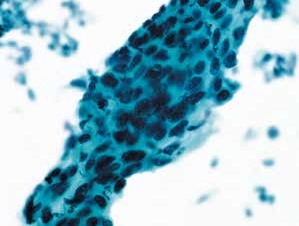
图4-45 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞成片排列,异型性明显,核膜不规则,核质比高。符合HSIL改变。
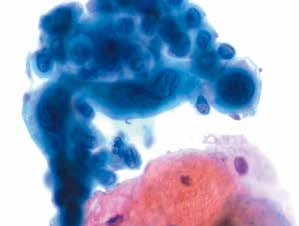
图4-46 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞异型性明显,核膜不规则,内陷,可见核沟。
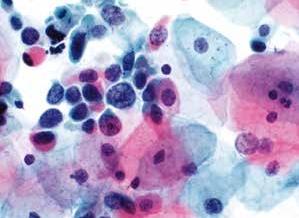
图4-47 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞核增大、深染,核膜不规则,胞质少,核质比高,凌乱排列。
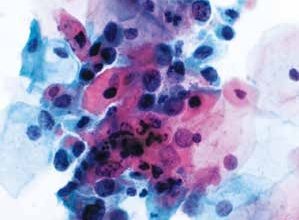
图4-48 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
较多不成熟鳞状上皮细胞,高核质比,胞核明显异型。符合HSIL改变。
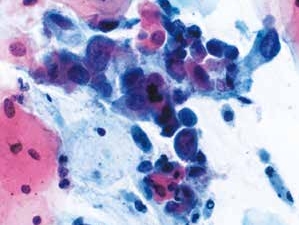
图4-49 高度鳞状上皮内病变(HSIL)(高倍、液基、巴氏染色)
细胞核明显增大,染色质粗糙深染,核膜不规则,胞质少,核质比高,排列凌乱。
(1)细胞排列:常常单个散在,有时片状排列或合胞体样聚集。
(2)细胞形态:细胞明显异型、细胞小如副基底样细胞,有时也可增大。
(3)细胞核:胞核变化较大,明显增大或相对较小,染色质深染,细颗粒状,也可粗糙,分布均匀,核仁一般不明显,核膜明显不规则,凸凹不平,甚至可见核沟。
(4)细胞质:较少,核质比(N/C)明显增高,有时异型细胞呈合胞体聚集,胞质边界不清。胞质常“不成熟”,表现为浅染、化生性或角化性的浓染。
(5)背景:清洁,无肿瘤素质。
诊断的关键:高核质比,核膜明显不规则,染色质增粗或成块,胞质“不成熟”。
浸润性鳞状细胞癌是子宫颈最常见的恶性肿瘤,细胞形态特征为:细胞多形性,异型性明显,突出的核仁,异常的染色质,胞质角化以及肿瘤素质。肿瘤素质是指:变性的细胞、细胞碎片、纤维蛋白、陈旧性出血及坏死。浸润性宫颈鳞癌50%~60%伴有肿瘤素质。
根据细胞形态不同分为角化型和非角化型两类。
1. 角化型鳞状细胞癌(keratinized squamous cell carcinoma)(图4-50~4-64)
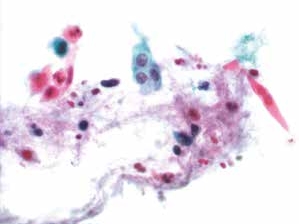
图4-50 角化型鳞癌(高倍、液基、巴氏染色)
肿瘤素质:变性细胞、坏死性碎片及陈旧性出血。此为鳞癌与HSIL的鉴别点之一,浸润性宫颈鳞癌常伴有肿瘤素质。
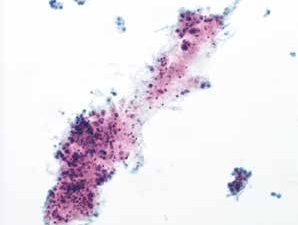
图4-51 角化型鳞癌(中倍、液基、巴氏染色)
肿瘤素质:坏死性碎片、纤维蛋白及陈旧性出血。HSIL的背景相对干净,鳞癌常伴有肿瘤素质。
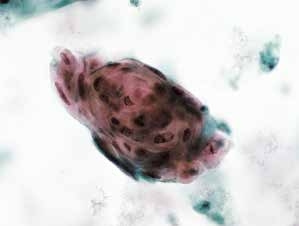
图4-52 角化型鳞癌(高倍、液基、巴氏染色)
癌性角化珠,细胞异型性明显,角化型鳞状细胞癌可见此癌性角化珠。
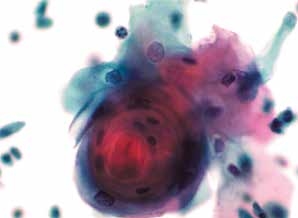
图4-53 角化型鳞癌(高倍、液基、巴氏染色)
癌性角化珠,角化型鳞状细胞癌可见。

图4-54 角化型鳞癌(高倍、液基、巴氏染色)
癌细胞多形性明显,核膜不规则,染色深。细胞成群,排列紊乱。
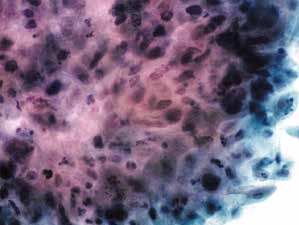
图4-55 角化型鳞癌(高倍、液基、巴氏染色)
癌细胞多形性明显,核膜不规则,染色深。细胞簇周围见少许黏附的肿瘤素质。
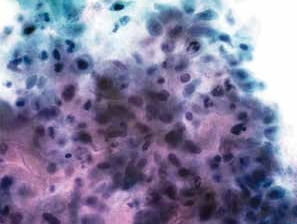
图4-56 角化型鳞癌(高倍、液基、巴氏染色)
与图4-55为同一病例的不同视野。
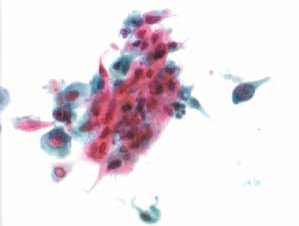
图4-57 角化型鳞癌(高倍、液基、巴氏染色)
癌细胞多形性,深染,核膜不规则,胞质角化明显。肿瘤素质较传统涂片少见,多聚集在细胞簇周围,液基制片称“黏附的肿瘤素质”,图中见少许坏死物质。
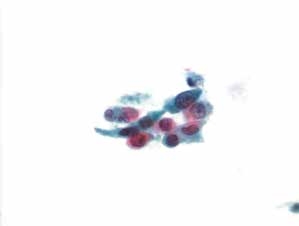
图4-58 角化型鳞癌(高倍、液基、巴氏染色)
注意中上方少许黏附性肿瘤素质。与图4-57为同一病例的不同视野。
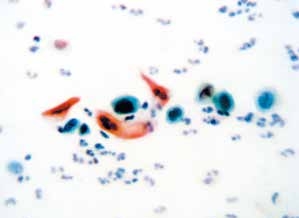
图4-59 角化型鳞癌(高倍、涂片、巴氏染色)
癌细胞单个散在,异型性明显,胞质角化。
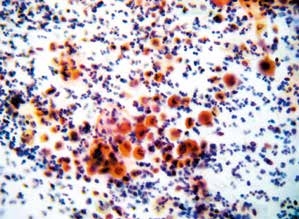
图4-60 鳞癌(中倍、涂片、巴氏染色)
多量散在的大小形态各异的癌细胞,伴炎性背景。角化型鳞癌中癌细胞单个散在,聚集的细胞团较少。
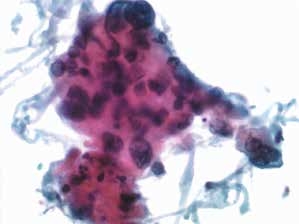
图4-61 角化型鳞癌(高倍、液基、巴氏染色)
癌细胞排列紊乱,异型性明显,核膜不规则,细胞呈片状,胞界不清。
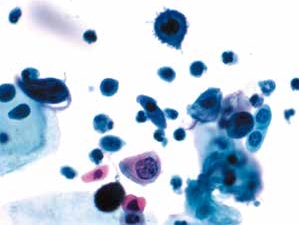
图4-62 角化型鳞癌(高倍、液基、巴氏染色)
癌细胞奇形怪状,异型性明显。
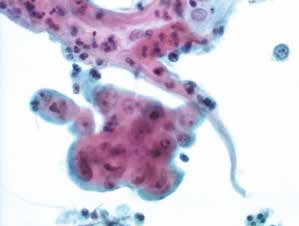
图4-63 角化型鳞癌(高倍、液基、巴氏染色)
癌细胞聚集,胞核圆形,核仁明显,肿瘤素质不很明显。
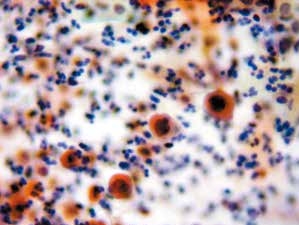
图4-64 角化型鳞癌(高倍、传统、巴氏染色)
癌细胞单个散在,核膜不规则,胞质角化,核质比高。
(1)细胞排列:多为单个散在,少见聚集的细胞团。
(2)细胞形态:细胞较大、多形性,可见梭形、蝌蚪状或奇异形状的细胞。
(3)细胞核:大小差异较大,核膜不规则,染色质深染、粗糙、不均匀分布,有时可见大核仁。
(4)胞质:橘黄色深染,角化。
(5)背景:可见肿瘤素质。
2. 非角化型鳞状细胞癌(non-keratinized squamous cell carcinoma)(图4-65~4-70)
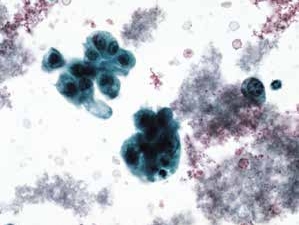
图4-65 非角化型鳞癌(高倍、液基、巴氏染色)
明显的肿瘤素质,癌细胞成团,形态多样,核大,深染,染色质粗颗粒状,胞质蓝染。
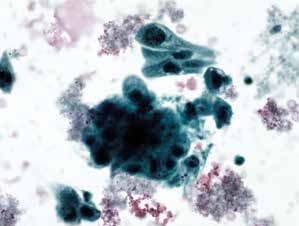
图4-66 非角化型鳞癌(高倍、液基、巴氏染色)
与图4-65为同一病例的不同视野,注意背景中的肿瘤素质十分明显。
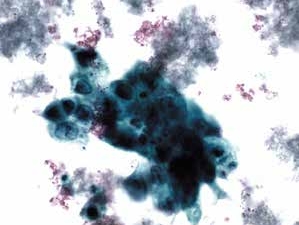
图4-67 非角化型鳞癌(高倍、液基、巴氏染色)
癌细胞成团排列,异型性明显,胞核增大深染,核仁可见,染色质粗颗粒状,胞质蓝染,肿瘤素质十分明显。
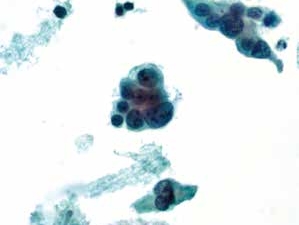
图4-68 非角化型鳞癌(高倍、液基、巴氏染色)
癌细胞成团排列,细胞核异型性明显,染色质粗颗粒状,胞质蓝染,高核质比,肿瘤素质可见。
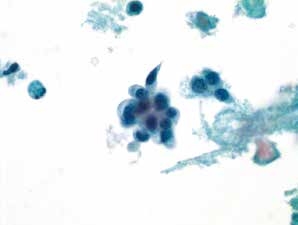
图4-69 非角化型鳞癌(高倍、液基、巴氏染色)
癌细胞成团排列,圆形、梭形,胞核深染,染色质粗颗粒状,核质比高,肿瘤素质可见。
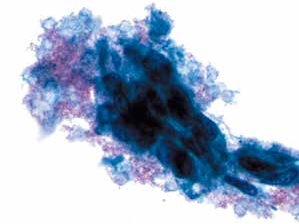
图4-70 非角化型鳞癌(高倍、液基、巴氏染色)
癌细胞片状排列,异型性明显,肿瘤素质清晰可见。液基制片坏死物聚集在癌细胞周围,称“黏附的肿瘤素质”。传统涂片肿瘤素质一般分布在背景中。
(1)细胞排列:单个散在,裸核常见。或为聚集合胞体样细胞群,细胞边界不清。
(2)细胞形态:中等大小,细胞相对一致,圆形或多角形。
(3)细胞核:染色质粗大而分布不均,核仁常见并较大,有时不规则。
(4)细胞质:嗜碱染,较少,核质比很高。
(5)背景:常见明显肿瘤素质(坏死性碎片及陈旧性出血)。
注:低倍,<20×;中倍,20×;高倍,>20×。