




这是一例比较典型的疑难危重感染病例,患者起病急,病情进展迅速,入院之初对感染的病原体判断非常困难,用以往比较多见的播散性结核、侵袭综合征或金黄色葡萄球菌感染都不能解释整个病情,因此无法选择非常精准的抗感染药物。综合考虑,给病人制订了倾向于抗结核的治疗方案,同时这个方案中包含具有抗革兰阳性球菌的药物,希望能覆盖到其他病原体。根据患者的治疗反应,这个方案起到了作用,控制住了病情的发展。但病原学未明,疗程难定。通过更加精准的抗菌治疗,收到了非常好的治疗效果。
患者,男性,41岁,猪肉运输司机,江苏省如皋市人,2018年7月20日收入我科。
发热伴意识障碍、肢体无力1周余。
2018年7月12日晨家人发现患者倒地,当时呼之能应,精神萎靡,但四肢瘫软无力,胡言乱语,大小便失禁。至江苏省当地人民医院就诊,体温39.2℃,伴颈强直,脑膜刺激征阳性,肺部可闻及少许啰音。胸部CT(图2-1)示“右下肺见类圆形团块状稍高密度影,其内见气体影,右肺上叶近空洞样稍高密度影,周围见胸膜牵拉,胸膜不规则增厚。头颅CT示:脑内多发斑点状、小片状模糊密度影”。腹部CT(图2-2)示:肝脏、脾脏数枚小低密度影,肛周、脾周少许包裹性积液;左肾上极占位。给予布洛芬口服退热,但患者出现神志模糊,对答不切题,伴有可疑的癫痫发作,请神经内科会诊后考虑结核不能排除,遂转至南通市某医院呼吸科就诊。追问病史,患者起病前两周曾有上呼吸道感染病史,表现为少许咳嗽咳痰。
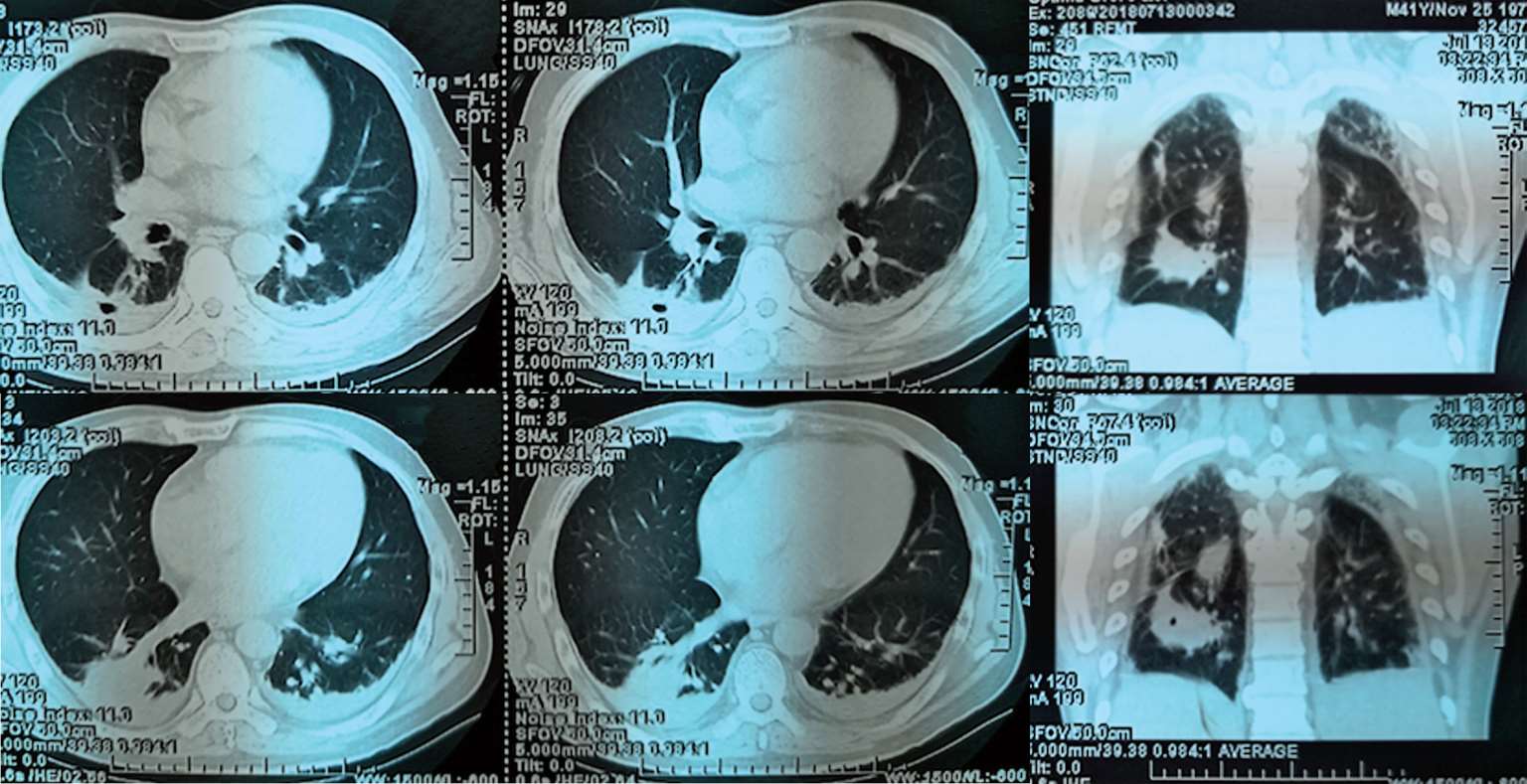
图2-1 2018年7月13日肺CT平扫:右下肺见类圆形团块状稍高密度影,其内见气体影,右肺上叶近空洞样稍高密度影,周围见胸膜牵拉,胸膜不规则增厚
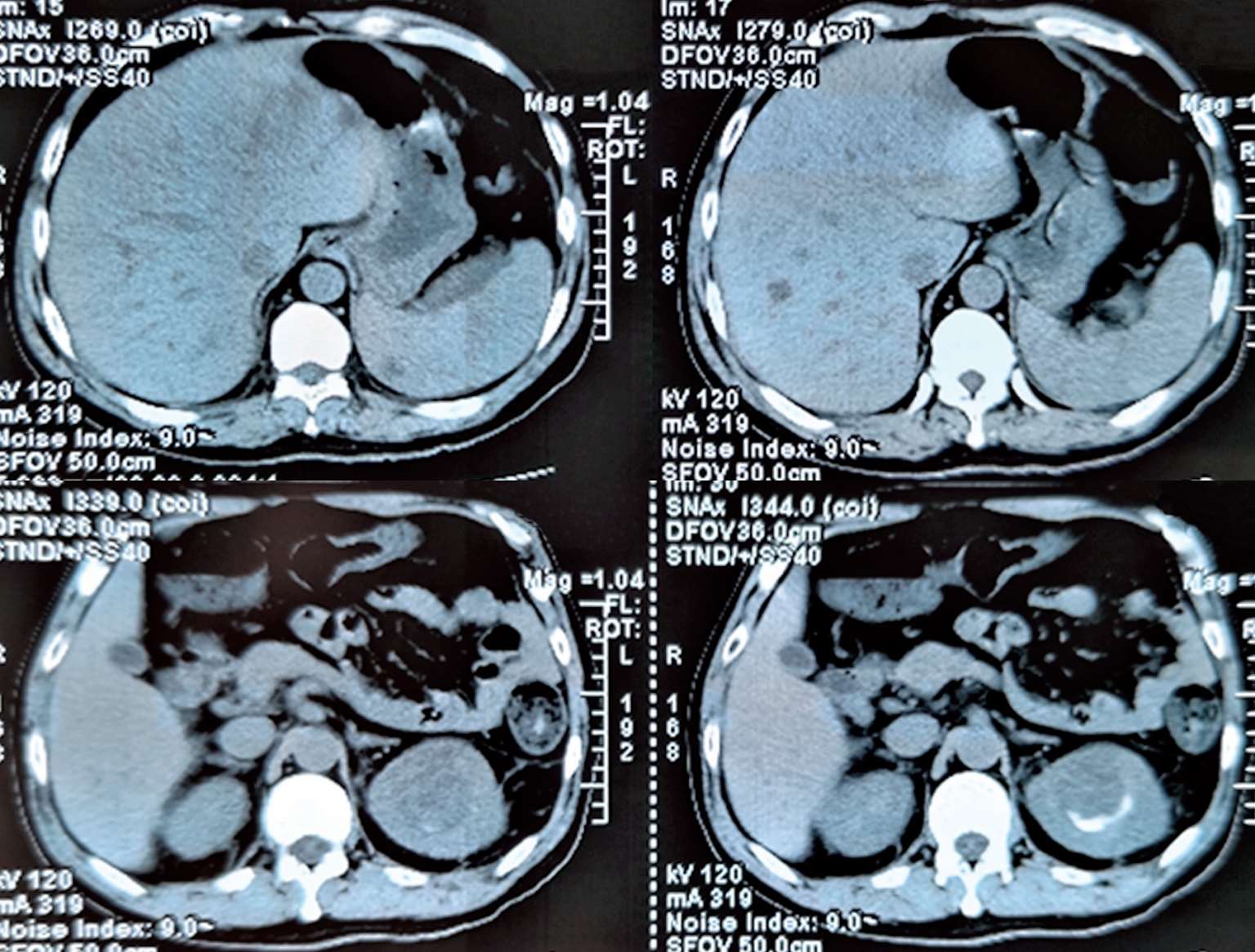
图2-2 2018年7月13日腹部CT平扫:肝脏、脾脏数枚小低密度影,肛周、脾周少许包裹性积液;左肾上极占位
江苏省当地人民医院7月13日行腰穿检查,脑脊液葡萄糖1.33 mmol/L(↓),蛋白质2 644.5 mg/L(↑),脑脊液有核细胞数150×10 6 /L(↑),多核细胞25%。头颅增强MRI(图2-3)示“脑实质内、右侧侧脑室后角内多发异常信号影,考虑感染性病变可能”。入院后予甘露醇、甘油果糖脱水,呋塞米、螺内酯利尿,哌拉西林/他唑巴坦、万古霉素、美罗培南抗感染,地塞米松(共5 mg)抗炎等治疗后,患者症状仍逐渐加重,仍有高热,四肢不自主颤动,进食后有呛咳,大小便失禁,意识障碍进一步加深,呈昏迷状态,双下肢肌力肌张力明显减退,于7月14日出院至我院急诊留观。
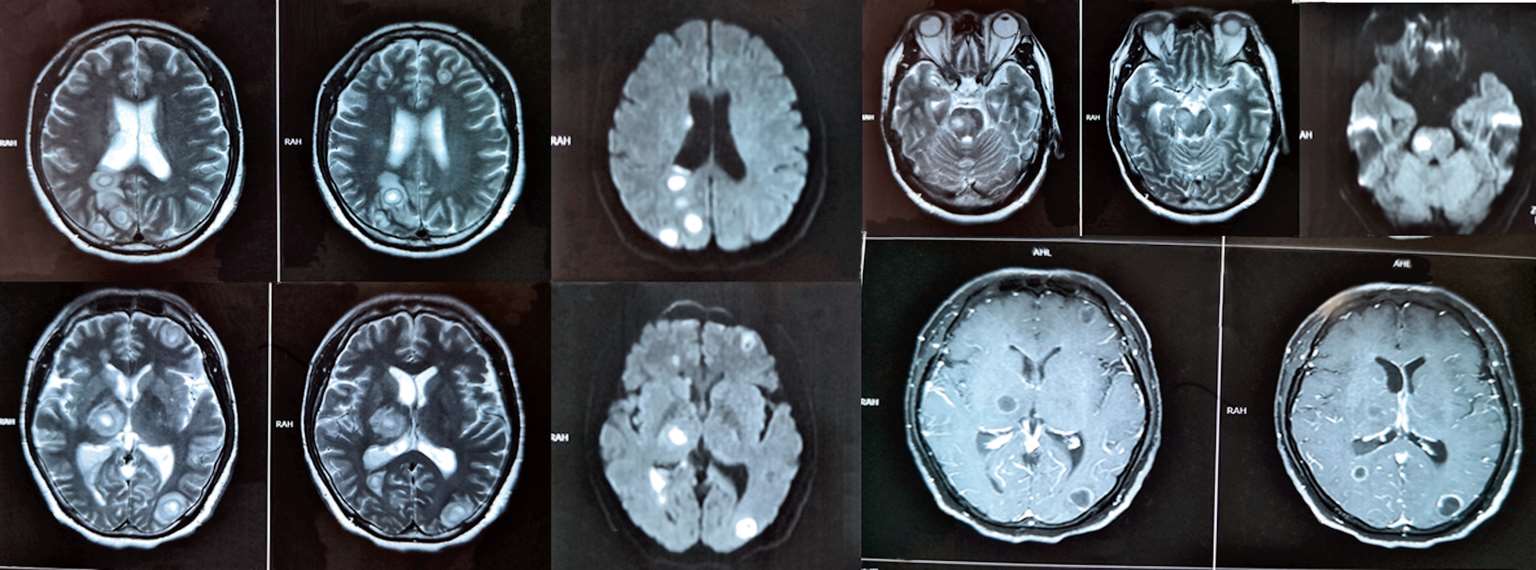
图2-3 2018年7月13日头颅增强MRI:脑实质内、右侧侧脑室后角内多发异常信号影,考虑感染性病变可能
我院急诊经相关检查后考虑“中枢神经系统感染,结核性脑膜脑炎可能大”,于7月14日晚开始予以诊断性抗结核并覆盖革兰阳性球菌(异烟肼0.6 g ivgtt qd,利福平0.45 g ivgtt qd,利奈唑胺0.6 g ivgtt q12h)治疗,保肝(还原型谷胱甘肽2.4 g ivgtt qd)、20%甘露醇250 ml ivgtt q8h脱水降颅压及补充白蛋白等对症处理,患者症状稍有改善,体温降至37.5℃,生命体征尚平稳,神志间断转清。7月20日为进一步诊治收住病房。
既往有糖尿病史半年,未予正规监测及治疗。有精神分裂症病史21年,长期服用氯氮平控制,症状可改善,现氯氮平早150 mg,晚300 mg口服,可帮助家人开车运送货物。无活禽、鸟类及猫狗接触史。有饮酒史10余年,平均250 g/d,常饮白酒,未戒酒,有酒精依赖性。
神志欠清,意识障碍,GCS评分7分,发育正常,营养中等,无法对答,查体不合作。全身皮肤黏膜未见异常,全身浅表淋巴结无肿大。未见皮疹及皮下出血点。头颅无畸形,睑结膜未见瘀点,巩膜无黄染。双侧瞳孔等大等圆,对光反射迟钝,眼球右侧凝视,口唇无发绀。颈强直,颈静脉无怒张,气管居中,甲状腺无肿大。胸廓对称无畸形,双肺呼吸音粗糙,右下肺呼吸音稍低,未闻及明显干、湿性啰音。心律齐。腹平坦,腹壁软,全腹无压痛,无肌紧张及反跳痛,肝脾肋下未触及,肝肾无叩击痛。双上肢肌力肌张力检查不配合,双侧下肢肌张力减退,肌力约1级。双侧巴氏征(+)。
● 血常规: 白细胞12.61×10 9 /L(↑),中性粒细胞82.1%(↑),血红蛋白132 g/L,血小板480×10 9 /L(↑)。
● 血沉40 mm/h(↑)。
● 降钙素原0.14 ng/ml(↑)。
● C反应蛋白36.8 mg/L(↑)。
● 铁蛋白1 394 ng/ml(↑)。
● EBV-DNA 5.25×10 3 copies/ml。
● G试验(1, 3-β-D葡聚糖) 79.44 pg/ml(↑),血隐球菌荚膜抗原乳胶凝集试验阴性。
● 血T-SPOT. TB 阴性: 抗原A(ESAT-6)孔0,抗原B(CFP-10)孔0,阴性对照孔0,阳性对照孔正常。
● 血培养阴性。
● 自身抗体、抗可溶性抗原抗体、抗中性粒细胞胞浆抗体均为阴性。
● 血、尿免疫固定电泳阴性。
● 肿瘤标志物 :CA125 58.51 U/ml(↑),余正常。
● 心超 :静息状态下经胸超声心动图未见明显异常,左心收缩功能正常,左心舒张功能正常。
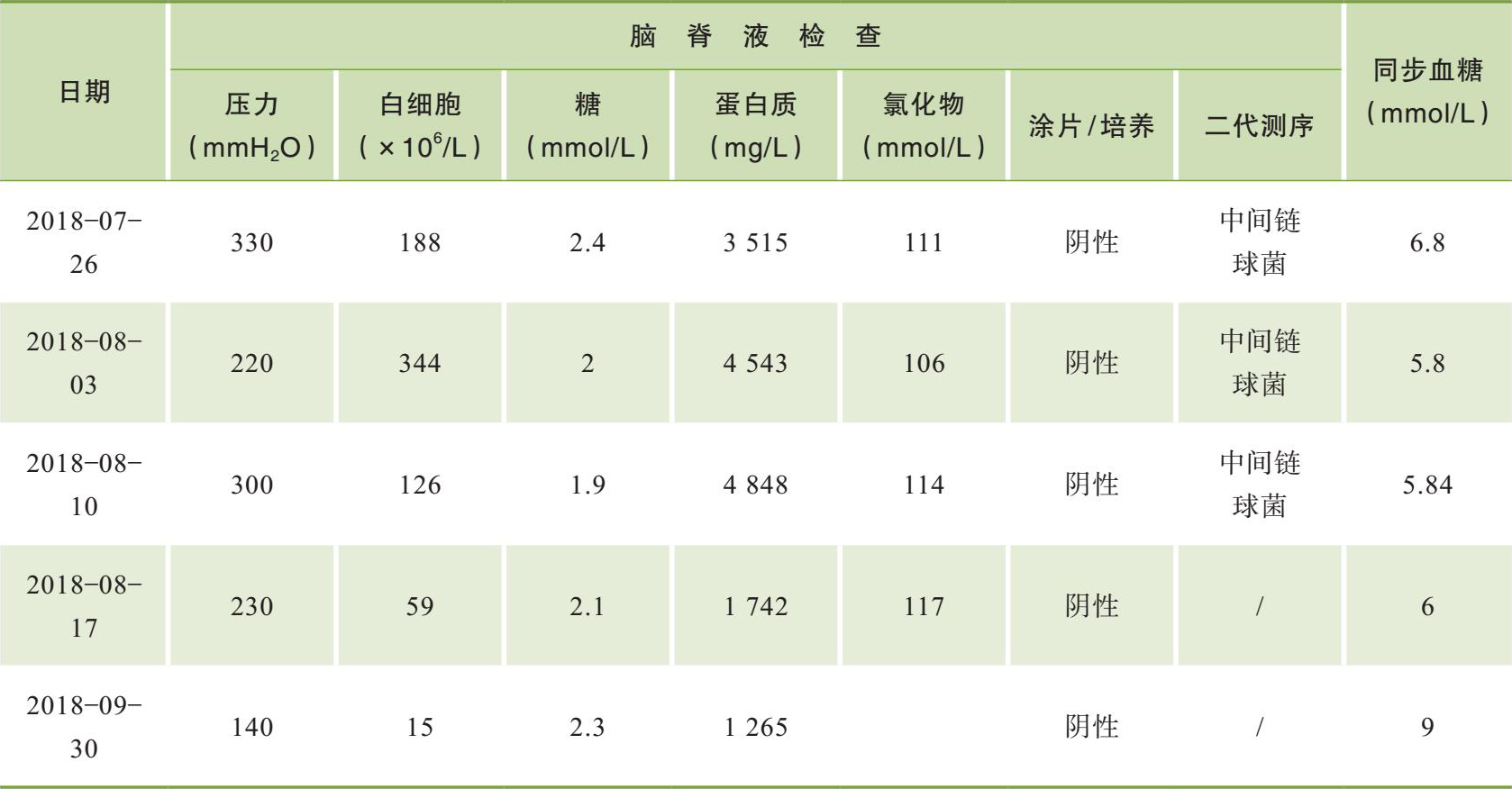
患者入院后7月23日行胸腰椎增强MRI(图2-4)见:TH11-L1水平脊髓肿胀,呈斑片状长T2信号,增强呈长环状强化。考虑“TH11-L1水平髓内占位,考虑脓肿可能,肿瘤不除外”。后行腰椎穿刺检查,压力330 mmH 2 O,脑脊液白细胞188×10 6 /L(↑),多核细胞34%,单核细胞66%,脑脊液糖2.4 mmol/L(↓),同步血糖6.8 mmol/L,脑脊液蛋白质3 515 mg/L(↑),脑脊液氯111 mmol/L(↓)(表2-1)。脑脊液隐球菌荚膜多糖抗原乳胶凝集试验阴性,脑脊液细菌和真菌培养均阴性。7月29日脑脊液二代测序回报(图2-5)测得中间链球菌,序列数114。
该患者以发热伴意识障碍起病,外周血白细胞及中性粒细胞比例明显升高,进一步检查发现颅内多发占位,DWI呈明显高信号,周围见水肿信号,增强后病灶呈环形强化;胸腰髓占位,增强病灶亦呈环形强化;肺内病灶伴空洞形成,肝脾也发现多枚低密度影,并发现左肾占位。腰穿查脑脊液中白细胞及蛋白质升高、糖降低,故首先考虑播散性感染可能大,转移性肿瘤待排。由于患者入院时症状及体温均有所好转,故继续坚持诊断性抗结核治疗,方案为:异烟肼0.6 g ivgtt qd,利福平0.45 g ivgtt qd,乙胺丁醇0.75 g po qd,阿米卡星0.6 g ivgtt qd,利奈唑胺0.6 g ivgtt q12h。
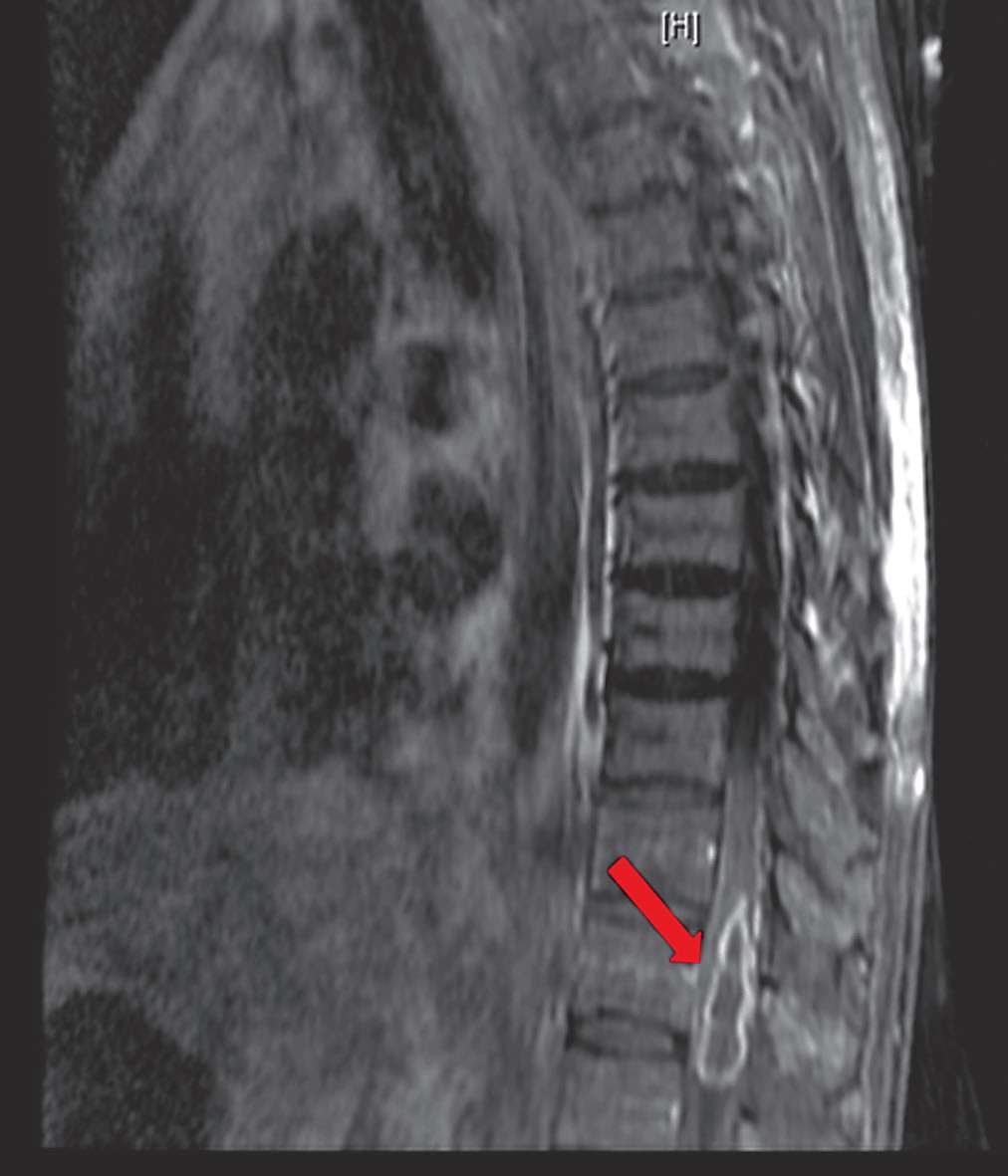
图2-42018年7月23日胸腰椎增强MRI |
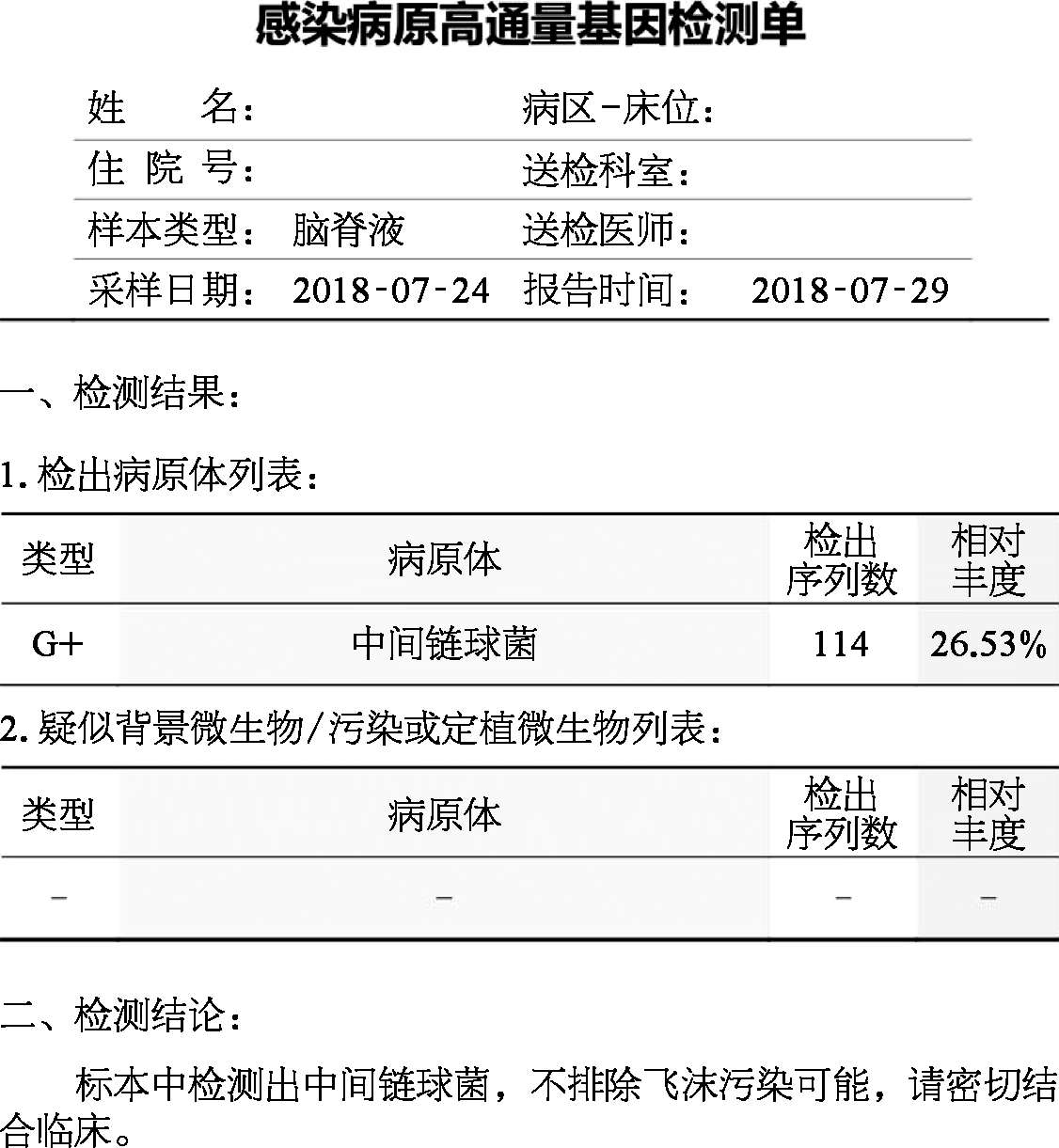
图2-52018年7月29日脑脊液二代测序 |
患者中年男性,以发热伴意识障碍起病,进一步检查发现颅内多发占位、胸腰髓占位、肺内病灶伴空洞形成,肝脾也发现多枚低密度影,并发现左肾占位。腰穿查脑脊液白细胞及蛋白质升高、糖降低,故首先考虑播散性感染可能大,转移性肿瘤待排。由于患者入院时症状及体温均有所好转,故继续坚持诊断性抗结核治疗。但反复追问病史,患者无既往结核病史或结核病患者密切接触史,而且查T-SPOT. TB 阴性,脑脊液的二代测序亦没有测得分枝杆菌序列,故我们始终对结核的诊断存疑,仍在积极寻找更精确的诊断。同时,由于中间链球菌广泛存在于口腔黏膜中,故第一次脑脊液二代测序结果并没有引起足够的重视,考虑污染不除外。
7月30日患者行上腹部增强CT(图2-6),发现肝脾的低密度影已几近消失不见,但回报左肾占位性病变,考虑肿瘤可能。7月30日复查血T-SPOT. TB 仍为阴性。入院治疗两周后8月3日复查腰穿,压力220 mmH 2 O,脑脊液白细胞344×10 6 /L(↑),多核细胞32%,单核细胞68%,脑脊液糖2 mmol/L( ↓),同步血糖5.8 mmol/L,脑脊液蛋白质4 543 mg/L(↑),脑脊液氯106 mmol/L(↓)(表2-1)。脑脊液隐球菌荚膜抗原乳胶凝集试验及培养仍为阴性。此次脑脊液白细胞及蛋白质较前进一步升高,糖进一步下降。虽然此时患者体温已降至正常,但8月7日复查头颅增强MRI(图2-7)见颅内多发异常环形强化灶,部分病灶较前似有所增大,肺部CT平扫却见肺部病灶较前明显吸收减少。同时8月7日第二次脑脊液二代测序回报再次测得中间链球菌,序列数106。
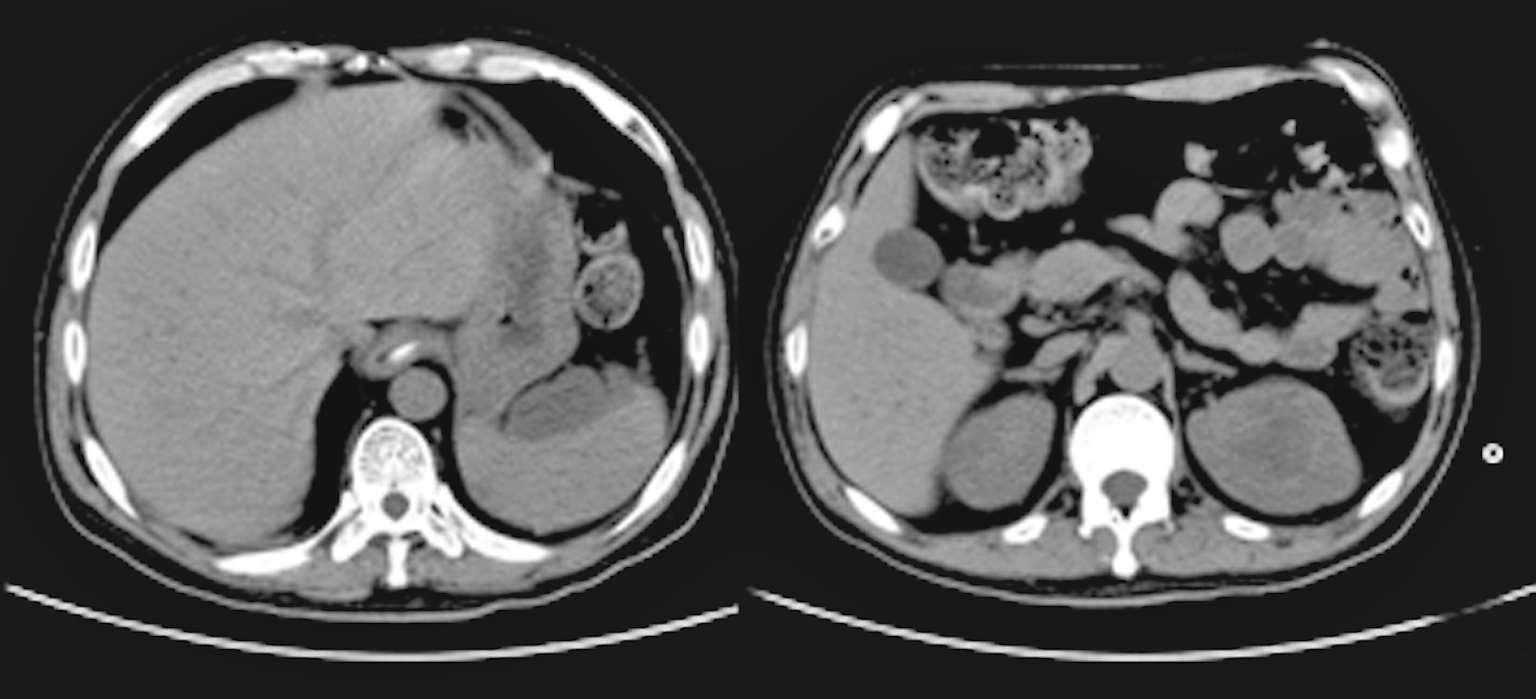
图2-6 2018年7月30日上腹部增强CT
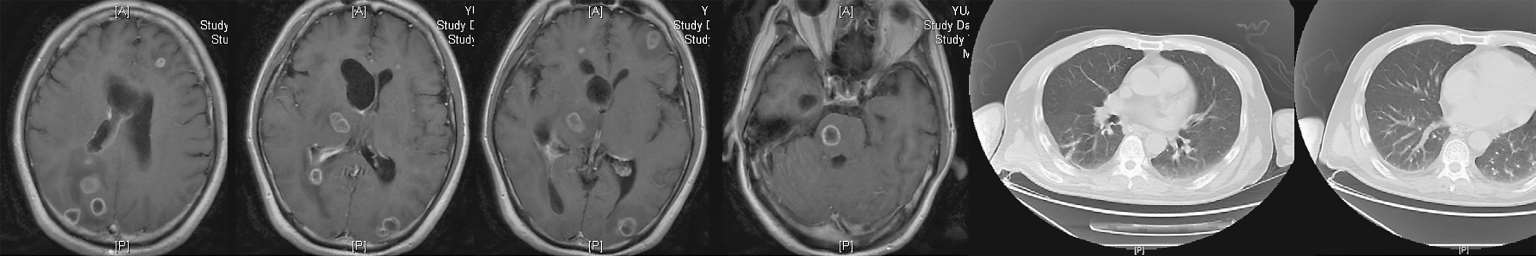
图2-7 2018年8月7日头颅增强MRI及肺部CT平扫
表2-1 脑脊液随访表及治疗经过
经过两周的诊断性抗结核治疗,该患者体温已降至正常,神志略有恢复,呼之可睁眼,无法对答,双侧下肢肌力及肌张力无恢复。肺及肝、脾的病灶明显吸收,颅内占位及脑脊液却没有同步好转。两次血T-SPOT. TB 均为阴性,同时两次脑脊液二代测序均测得中间链球菌的序列。根据目前利奈唑胺对革兰阳性球菌的药物敏感性监测结果,中间链球菌对利奈唑胺是敏感的。结核的诊断仍无任何依据,而播散性中间链球菌感染,既可造成患者多部位感染,又解释了使用含有利奈唑胺的治疗方案后病情的部分好转。
因此,我们于8月9日停用利福平、异烟肼、乙胺丁醇及阿米卡星,改为利奈唑胺0.6 g ivgttq12h联合青霉素640万U ivgtt q8h抗链球菌治疗。8月10日再次行腰穿,结果较前相似,同时脑脊液第三次送二代测序仍测得中间链球菌,序列数147。更改抗感染方案一周后,8月17日复查腰穿,压力230 mmH 2 O,脑脊液白细胞59×10 6 /L(↑),多核细胞3.4%,单核细胞96.6%,脑脊液糖2.1 mmol/L(↓),同步血糖6 mmol/L,脑脊液蛋白质1 742 mg/L(↑),脑脊液氯117 mmol/L(↓)(表2-1),脑脊液较前明显好转。同时患者症状有明显好转,可简单应答,间断伴有躁动,双下肢肌力逐渐恢复至3级。
8月22日复查头颅及胸腰椎增强MRI示病灶均较前明显好转(图2-8)。患者已能对答切题及按照指令动作,GCS评分15分,拔除胃管后可自行进食。8月23日,调整方案为头孢曲松2 g ivgtt q12h联合青霉素640万U ivgtt q8h继续抗链球菌治疗。9月30日复查腰穿,脑脊液较前进一步好转(表2-1)。10月9日复查头颅、胸腰椎增强MRI及肺CT,病灶均进一步缩小(图2-9)。
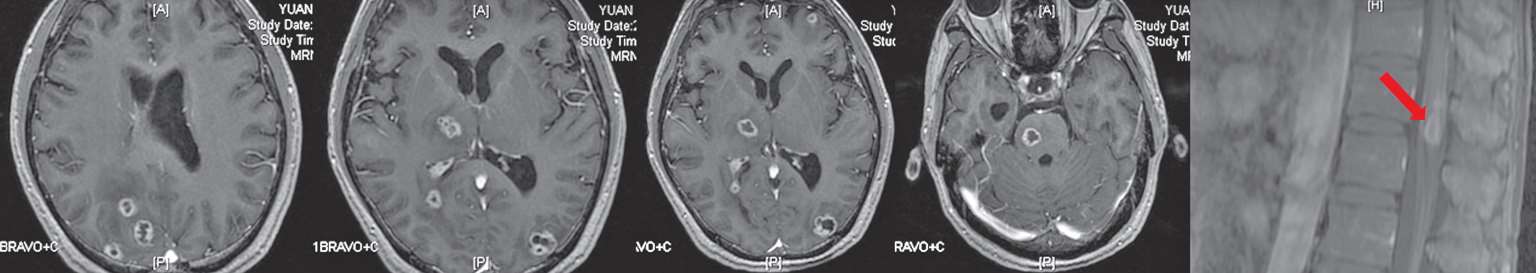
图2-8 2018年8月22日头颅及胸腰椎增强MRI
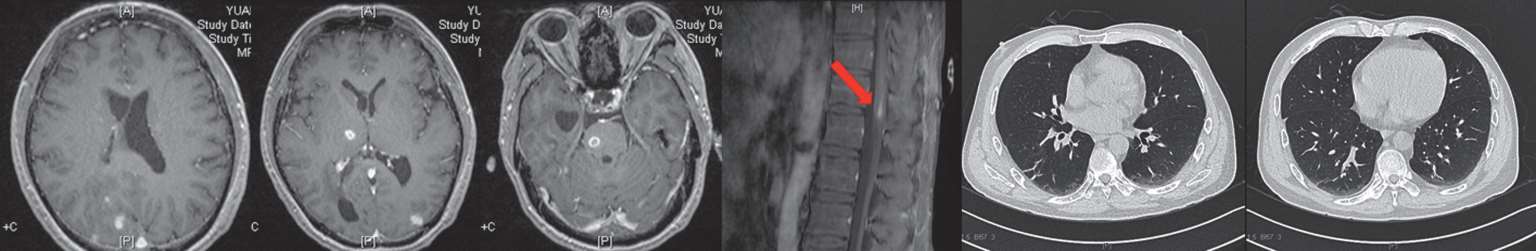
图2-9 2018年10月9日头颅、胸腰椎增强MRI、肺平扫CT
在住院期间,患者7月30日上腹部增强CT曾发现左肾占位性病变,考虑肿瘤可能,待病情较为稳定后,8月27日行肾脏增强CT(图2-10)示左肾上极占位,考虑透明细胞癌可能。请泌尿外科会诊,考虑患者目前手术风险较大,家属也暂拒绝手术,故进一步随访中。因此综合分析该患者的病情,考虑是肾脏肿瘤基础上发生的播散性中间链球菌感染。
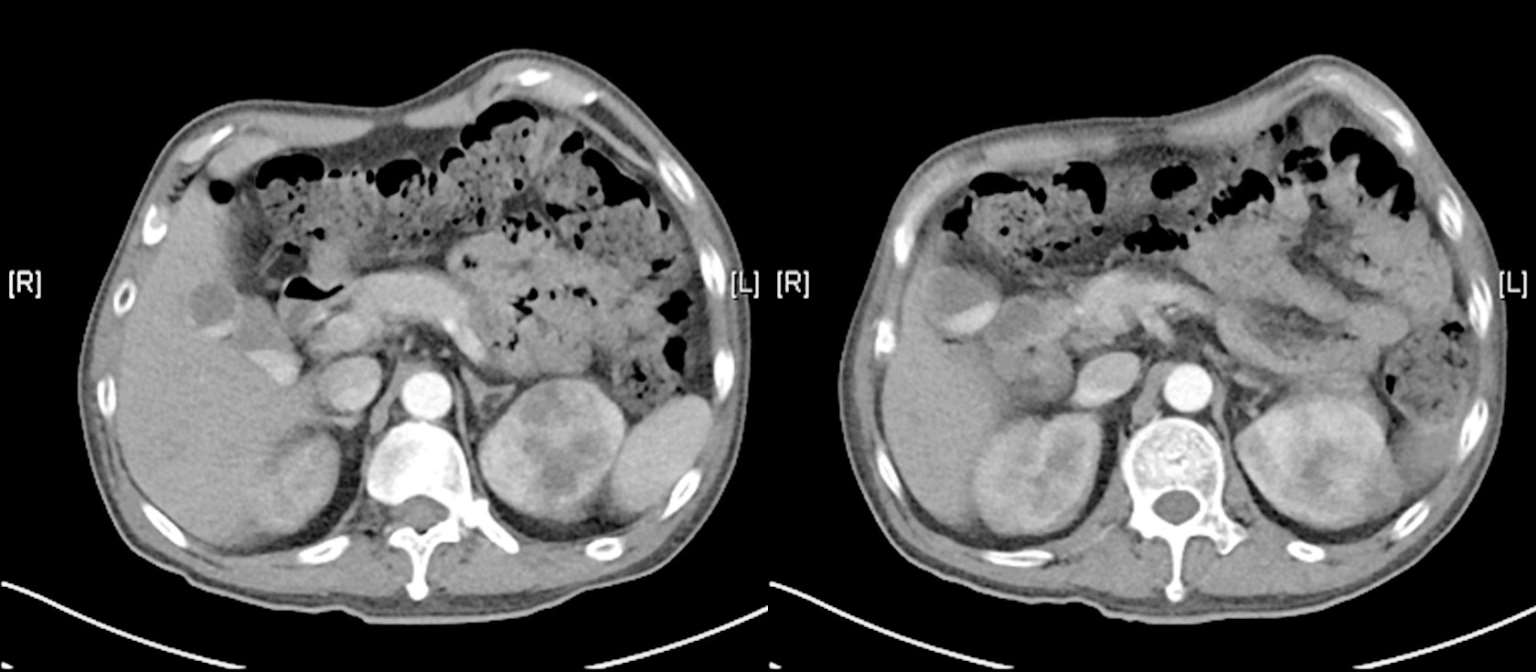
图2-10 2018年8月27日肾脏增强CT
中间链球菌( Streptococcus intermedius )和星座链球菌( S. constellatus )、咽峡炎链球菌( S. anginosus )共同组成了咽峡炎链球菌群( Streptococcus anginosus group, SAG),曾经也被称为米勒链球菌群( Streptococcus milleri group),在口腔黏膜、泌尿生殖道、消化道等多处都有定植,可引起肝脏、脾脏、颅脑等化脓性炎症,也可导致咽喉炎、牙龈炎及感染性心内膜炎等侵袭性感染。中间链球菌可表达表面蛋白-抗原Ⅰ/Ⅱ,有报道称该表面蛋白可与人体组织中的纤连蛋白和层粘连蛋白结合,诱导单核细胞释放IL-8,促进中性粒细胞的驱化和激活,进而引起促炎性细胞因子的聚集,导致组织损伤和脓肿形成。中间链球菌表面的多糖荚膜则可阻碍吞噬。此外,该链球菌群分泌的一系列水解酶,如透明质酸酶、脱氧核糖核酸酶可加速组织液化形成脓液。其中透明质酸酶还参与生物膜形成,帮助菌体逃避宿主攻击和抗生素的作用。
在邻近部位细菌入侵导致的脑脓肿病例中,链球菌是最常见的病原体之一。关于中间链球菌导致脑脓肿的报道最早可追溯至1975年。AlMasalma等学者2009年的研究利用培养及16S rDNA测序的方法鉴定了20位脑脓肿患者的病原体,其中5位患者(25%)的脓肿样本中均检测到了中间链球菌。另一篇纳入了49例脑脓肿患者的回顾性研究也发现,咽峡炎链球菌群是最常见的病原体。中间链球菌导致的脑脓肿可表现为独立的或者多发的病灶,缺乏特异的临床表现,尽管培养是确诊的金标准,但由于经验性抗感染药物的使用及颅内病灶取样的风险较高等原因,中间链球菌的培养阳性率并不高,16S rDNA测序以及新的测序技术等分子生物学方法则极大地提高了诊断的阳性率,为临床用药提供了强有力的依据。培养阴性而病原体测序阳性的病例报道及回顾性研究并不少见。
中间链球菌致脑脓肿的危险因素包括黏膜感染(牙周炎、鼻窦炎、中耳乳突炎)、肺部感染、酗酒、糖尿病及某些先天性心脏病等。也有研究显示,肿瘤、肝硬化、激素及免疫抑制剂的使用等免疫功能低下疾病是中间链球菌感染播散的危险因素。本例患者在意识障碍之前也有上呼吸道感染的病史,且病初的检查提示有肺部炎症病灶伴有空洞形成,推测肺部中间链球菌的感染可能是播散的源头,而住院期间进一步查出患者左肾占位,透明细胞癌可能,也解释了在该患者身上感染会广泛播散的原因。
中间链球菌对β-内酰胺类抗生素普遍较为敏感,可选择青霉素、头孢菌素、碳青霉烯类药物。另有研究或病例报道表明,万古霉素、替考拉宁、利福平、利奈唑胺等对中间链球菌脑脓肿也有较好的疗效。对于病原已经明确的中间链球菌导致的脑脓肿,推荐首选青霉素G或者第三代头孢菌素治疗。
中间链球菌引起脑脓肿的病例报道并不少见,但由于病原学检测的局限性,以往中间链球菌脑脓肿,特别是像这例播散性中间链球菌感染的病例还是非常少见的。这个患者入院后多次腰穿送脑脊液培养,包括脑脊液打入血培养瓶的方法,均未获得阳性结果。二代测序再次显示了优越性,我们最初对第一次脑脊液二代测序的阳性结果持怀疑态度,但3次脑脊液二代测序均检测到中间链球菌,使我们不得不引起重视。根据这个结果调整治疗方案后,患者病情迅速缓解,也印证了二代测序结果的正确性。出乎意料的是,患者的多个病灶最终是二元论解释,即肾脏占位是肿瘤,在此基础上发生了累及脑、肺、肝、脾的播散性中间链球菌感染。
(王 璇 艾静文 邵凌云 张文宏)
[1] Mishra AK, Fournier PE. The role of Streptococcus intermedius in brain abscess [J]. Eur J Clin Microbiol Infect Dis, 2013, 32(4):477-483.
[2] Brouwer MC, Tunkel AR, McKhann GM 2nd, et al. Brain abscess [J]. N Engl J Med, 2014, 371(5): 447-456.
[3] Al Masalma M, Armougom F, Scheld WM, et al. The expansion of the microbiologicalspectrum of brain abscesses with use of multiple 16S ribosomal DNA sequencing [J]. Clin Infect Dis, 2009, 48(9): 1169-1178.
[4] Carpenter J, Stapleton S, Holliman R.Retrospective analysis of 49 cases of brain abscess and review of the literature [J]. Eur J Clin Microbiol Infect Dis, 2007, 26(1): 1-11.
[5] Petti CA, Simmon KE, Bender J, et al. Culture-negative intracerebral abscesses in children and adolescents from Streptococcus anginosus group infection: a case series [J]. Clin Infect Dis, 2008, 46(10): 1578-1580.
[6] Saito N, Hida A, Koide Y, et al. Culture-negative brain abscess with Streptococcus intermedius infection with diagnosis established by direct nucleotide sequence analysis of the 16s ribosomal RNA gene [J]. Intern Med, 2012, 51(2): 211-216.
[7] Tracy M, Wanahita A, Shuhatovich Y, et al. Antibiotic susceptibilities of genetically characterized Streptococcus milleri group strains [J]. Antimicrob Agents Chemother, 2001, 45(5): 1511-1514.
[8] Khatib R, Ramanathan J, Baran J Jr. Streptococcus intermedius: a cause of lobar pneumonia with meningitis and brain abscesses[J]. Clin Infect Dis, 2000, 30(2): 396-397.