




1986年以前,白细胞趋化物质主要认为有补体片段C5a、白三烯B4(leukotriene B4,LTB4)、血小板激活因子(platelet-activating factor,PAF)和N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formylmethionyl-leucyl-phenyl-alanine,fMLP),这些趋化物质的受体同属于G蛋白偶联受体。自1987年发现了第一个趋化因子CXCL8/IL-8以来,大量的趋化因子被发现,成为趋化因子家族。趋化因子是一类具有趋化功能、分子量为8~12kD的细胞因子,均含4个半胱氨酸的保守基序,组成特征性的两个二硫键。到目前为止,趋化性细胞因子家族的成员约有50种,其受体为7次跨膜G蛋白偶联受体。趋化因子和趋化因子受体之间作用方式具有交叉性,两者间可形成复杂的调节网络。
根据趋化因子不同的理化与生物特性,趋化因子的分类也有不同方式。
根据N端前两个半胱氨酸相对位置不同而将趋化因子分为4个亚家族,包括CXC趋化性细胞因子(属α亚家族)、CC趋化性细胞因子(属β亚家族)、C趋化性细胞因子(属γ亚家族)和CX3C趋化性细胞因子(属δ亚家族)。尽管趋化因子序列相似性较低,但三维结构存在显著的相似性,具有3个β片层、1个C末端α-螺旋和1个柔性N端结构域,且其中柔性结构域对于活化趋化因子受体是不可或缺的。
该类趋化因子近氨基端都存在CXC(半胱氨酸-任意氨基酸-半胱氨酸)基序,该类趋化因子包括16个成员,分别称为CXCL1~CXCL16,其编码这个亚类的基因大部分聚集定位于人4号染色体(q12-21)上。CXCL8(IL-8)是CXC趋化性细胞因子的一个代表,对中性粒细胞和未致敏的T淋巴细胞有趋化作用。
多种CXC趋化因子在N端和第一个半胱氨酸之间含一个共同的氨基酸基序ELR,即谷氨酸(glutamate)-亮氨酸(leucine)-精氨酸(arginine)。根据是否存在ELR序列,CXC类趋化因子分为:ELR-CXC和non-ELR-CXC趋化因子。ELR-CXC趋化因子是有效的血管生长因子,如CXCL8/IL-8、CXCL6(也称粒细胞趋化蛋白,granulocyte chemoattractant protein-2,GCP-2)、CXCL1[也称生长调节致癌基因α(growth-regulated oncogeneα,GROα)]等,这些趋化因子直接作用于内皮细胞促进血管生成,从而介导肿瘤的生长和转移。而non-ELR-CXC则抑制血管生成,包括CXCL4(也称血小板因子4,platelet factor-4,PF-4)、CXCL10(也称干扰素诱导蛋白10,interferon-inducible protein 10,IP-10)和CXCL9(也称INF-γ诱生的单核因子,monokine inducible by INF-γ,Mig)等。
该类趋化因子近氨基端只含有两个相邻的半胱氨酸(CC),其11个成员的编码基因位于人17号染色体(q11-21)上。大多数CC趋化性细胞因子,如CCL2/MCP-1和CCL8/MCP-2等,能趋化单核细胞/巨噬细胞、嗜酸性粒细胞、嗜碱性粒细胞和淋巴细胞,但不能趋化中性粒细胞。
该类趋化因子近氨基端两个半胱氨酸间存在3个其他氨基酸残基,染色体基因定位于16号染色体q13上。目前只发现一个该型趋化性细胞因子CX3CL1/Fractalkine,分为膜型和分泌型两种形式,其中分泌型在酶切之后才发挥其生物学效应,对单核细胞、NK细胞和T淋巴细胞有较强的趋化作用。
该类趋化因子近氨基端只有一个半胱氨酸(C),染色体基因定位于1q23。C趋化性细胞因子只含有两个成员,XCL1/Lymphotactin和XCL2/SCM-1β。C类趋化因子主要作用于成熟T淋巴细胞(特别是CD8 + T细胞)。
亦称自稳型趋化因子,该类趋化因子高表达于胸腺、淋巴结、脾脏,其表达水平稳定,主要参与淋巴细胞(初始T细胞、胸腺细胞和记忆细胞)的成熟、归巢和再循环,维持淋巴系统的稳定,如CCL19和CCL21可介导白细胞从外周组织进入淋巴器官,参与免疫器官发育和抗原呈递。此外,皮肤、小肠和黏膜细胞表达组成型趋化因子,与组织特异性淋巴细胞归巢相关,如CCR9介导T细胞迁移至小肠黏膜固有层,CCR10可介导T细胞迁移至皮肤组织,CXCR4介导造血干细胞进入骨髓。组成型细胞因子与其受体具有相对的专一性,即一种趋化因子仅与1~2种趋化因子受体结合,反之亦然。
亦称炎性趋化因子,该类细胞因子在生理状态下并不表达,在组织炎症或损伤时,释放的炎性细胞因子或细菌毒素诱导其高表达。该类趋化因子包括趋化中性粒细胞的CXC类的ELR亚类和趋化嗜酸性粒细胞、单核细胞和淋巴细胞的CC类趋化因子,如CCL5。诱导型趋化因子的受体与配体的结合缺乏专一性,即一种趋化因子受体可结合多种趋化因子,一种趋化因子也可以结合多种受体,具有广泛的选择性。
某些趋化因子并不能明确的归类为上述任一类趋化因子,称之为双功能趋化因子,如组成型CCL22也可以诱导性表达。这类趋化因子不仅具有免疫防御功能,参与某些炎症反应,同时也可参与胸腺T细胞的发育,维持免疫自稳。双功能趋化因子与其受体结合也具有一定的特异性。
一些微生物成分及代谢产物也具有介导白细胞定向运动的功能,包括脂类物质(如PAF、LTB4)、多肽(C5a、fMLP等)、蛋白质如高迁移率族蛋白1(high mobility group box 1 protein,HMGB1)。这些物质的分子结构及作用机制有别于趋化因子,称之为非经典趋化因子。
趋化因子受体广泛表达于中性粒细胞、巨噬细胞等骨髓来源的各白细胞亚群,也表达于上皮细胞、血管内皮细胞等结构细胞。仅少数趋化因子与其受体结合具有专一性,如CXCR4是CXCL12的唯一受体。大多数情况下,一种趋化因子受体可结合多个配体,而一种趋化因子也可以与多种趋化因子受体结合。这种趋化因子与受体的交叉性结合使一种趋化因子可以驱使表达有不同趋化因子受体的免疫细胞定向迁移,而一种免疫细胞也可以被多种趋化因子招募。此外,多数趋化因子与相应受体结合发挥正向效应,少数趋化因子结合受体后不传递信号,对趋化因子发挥清除作用。
趋化因子受体是一种7次跨膜的G蛋白偶联受体,它的N端位于细胞膜外侧,C端位于细胞膜内侧,有3个细胞外环和3个内环,其中一个细胞内环偶联异源三聚体的G蛋白,介导配体与受体的结合启动后续反应。分子内部形成的二硫键分别位于N端与第二个跨膜外环间及第一个与第三个跨膜外环间。与趋化因子一样,不同的趋化因子受体的氨基酸序列有20%~85%的同源性,特别是跨膜区和胞质内,且三级结构十分相似。
1998年国际药理学会命名委员会将趋化因子受体与配体分为四类,并进行了标准命名,分别用CC、CXC、CX3C后面加上R和一个数字来表示,目前已发现的功能性受体包括 CCR1~11、CXCR1~6、CX3CR1、XCR1~2。这一家族的受体是G蛋白偶联受体,由七个疏水性的跨膜区组成。当受体与相应的配体结合后,经偶联GTP结合蛋白引发钙内流信号,导致胞质内钙离子浓度增高。信号通路转导的具体过程为趋化因子与受体结合后引起受体构象改变,激活偶联的G蛋白形成Gα-ATP复合物并与βγ亚基分离,激活磷脂酶C(PLC)、磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)及酪氨酸激酶等,产生三磷酸肌醇(inositol-1,4,5 trisphosphate,IP3),促使细胞外钙离子内流和细胞储存钙离子释放,激活肌凝蛋白和肌动蛋白,刺激细胞骨架发生改变,肌动蛋白丝聚合、收缩,细胞的移动性增加,同时这些信号也促使整合素发生构象改变,增加其与配体的亲和力,在其协同作用下,细胞发生定向迁移、聚集。
CCR1的配体为CCL3(也称巨噬细胞炎性蛋白1α,macrophage inflammatory protein-1α,MIP-1α)和CCL5(也称调节T细胞激活性低分泌因子,reduced upon activation normal T cell expressed and secreted factor,RANTES),主要表达于单核细胞、中性粒细胞、T细胞、B细胞和嗜酸粒粒细胞以及肝、肺等组织。CCR4主要表达于嗜酸性粒细胞,与CCL5结合诱导嗜酸性粒细胞趋化。CCR4主要表达于嗜酸性粒细胞和各种淋巴组织,CCR4 + CD4 + T细胞可被诱导趋化到肝脏组织,参与炎症损伤,CCR4还可作为Th2细胞的选择性标志之一。
CXCR1和CXCR2主要与IL-8和其他多种配体结合,CXCR3主要表达于激活的T细胞上、CXCR4主要表达于单核细胞、中性粒细胞、淋巴细胞和激活的T细胞上,它是HIV感染T细胞的协同受体,CXCR5主要表达于成熟的B细胞表面,CXCR6主要表达于NK、T细胞、活化的CD4 + T细胞和CD8 + T细胞上。
CX3CR趋化因子受体主要表达于单核细胞、中性粒细胞、T细胞和活化的NK细胞及中枢神经组织。在HIV感染中,CX3C可趋化大量CD8 + CX3CR + 细胞进入中枢神经系统,引起神经损伤。CX3CR1是CX3CL1的专一性受体。可溶性CX3CL1可活化受体CX3CR1,后者活化可诱导蛋白激酶Akt的活化,引起下游NF-κB的核转位。
非典型趋化因子受体(atypical chemokine receptor,ACKR)的发现增加了趋化因子受体研究的复杂性,该类受体的序列和结构与经典趋化因子受体相似,也能特异性结合趋化因子,但由于G蛋白偶联受体相关的DRYLAIV结构的突变和缺失,导致其无法向下游转导信号,反而对趋化因子有抑制和清除的作用,亦称诱饵受体(decoy receptor)、清道夫受体(scavenger receptor,SR)。目前已发现4类ACKR,分别是ACKR1/Duffy抗原趋化因子受体、ACKR2/D6、ACKR3/CXCR7、ACKR4/CCRL1。这类趋化因子与配体结合后有两种结局,一种是与溶酶体结合后发生降解和清除作用,另一种是帮助胞吞配体完成跨细胞转运。最近研究表明,ACR是通过β-抑制蛋白(β-arrestin)依赖的信号通路的激活,从而对配体进行吸收、降解、跨细胞运输或呈递。这类受体在调节炎症反应、免疫应答、组织损伤修复、胚胎发育等过程中发挥重要作用,也与某些免疫性疾病、肿瘤等关系密切。
又称Duffy抗原趋化因子受体(Duffy antigen receptor for chemokine,DARC),是红细胞膜上的一种多功能杂合性趋化因子受体。ACKR1不仅是位于红细胞膜表面的血型抗原,同时也是间日疟原虫受体、HIV辅助受体。该类趋化因子受体可与促进血管生成作用的趋化因子结合,如含ELR基序的CXC类趋化因子和某些CC类趋化因子,ACKR1配体与之结合具有高度的亲和力。除清除血液循环和局部组织趋化因子外,ACKR1还可介导白细胞穿过血管内皮细胞。
又称D6,是一个针对炎性CC族趋化因子进行诱骗和内化的受体,当趋化因子与ACKR2结合后进入胞内溶酶体中,趋化因子被降解,而ACKR2则重新回到细胞表面循环,同时上调ACKR2表达以清除更多的趋化因子。淋巴管内皮细胞是ACKR2主要表达细胞,白细胞上也表达ACKR2,可清除炎性趋化因子,促进炎症消退。
旧称CXCR7,该受体原本定义属于G蛋白偶联受体,但随着研究深入,学者们发现其没有经典的DRYLAIV结构域,取而代之的是DRYLSIT,所以从功能上划分,更接近与非典型趋化因子受体。ACKR3氨基酸序列与CXCR4相似,可与CXCL11和CXCL12结合,在干细胞分化、血管生成及多种肿瘤的发展过程中扮演重要角色。
旧称CCRL1,不仅广泛表达于脾、心、肺、肾、脑、小肠等器官,还表达于树突状细胞、T细胞等免疫细胞和基质细胞中。ACKR4的配体有CCL19、CCL21、CCL25和CXCL13,特别是对CCL19和CCL21具有高亲和力,并能够内化和降解这些趋化因子,这些配体能促进多种肿瘤的生长和转移(图5-4)。
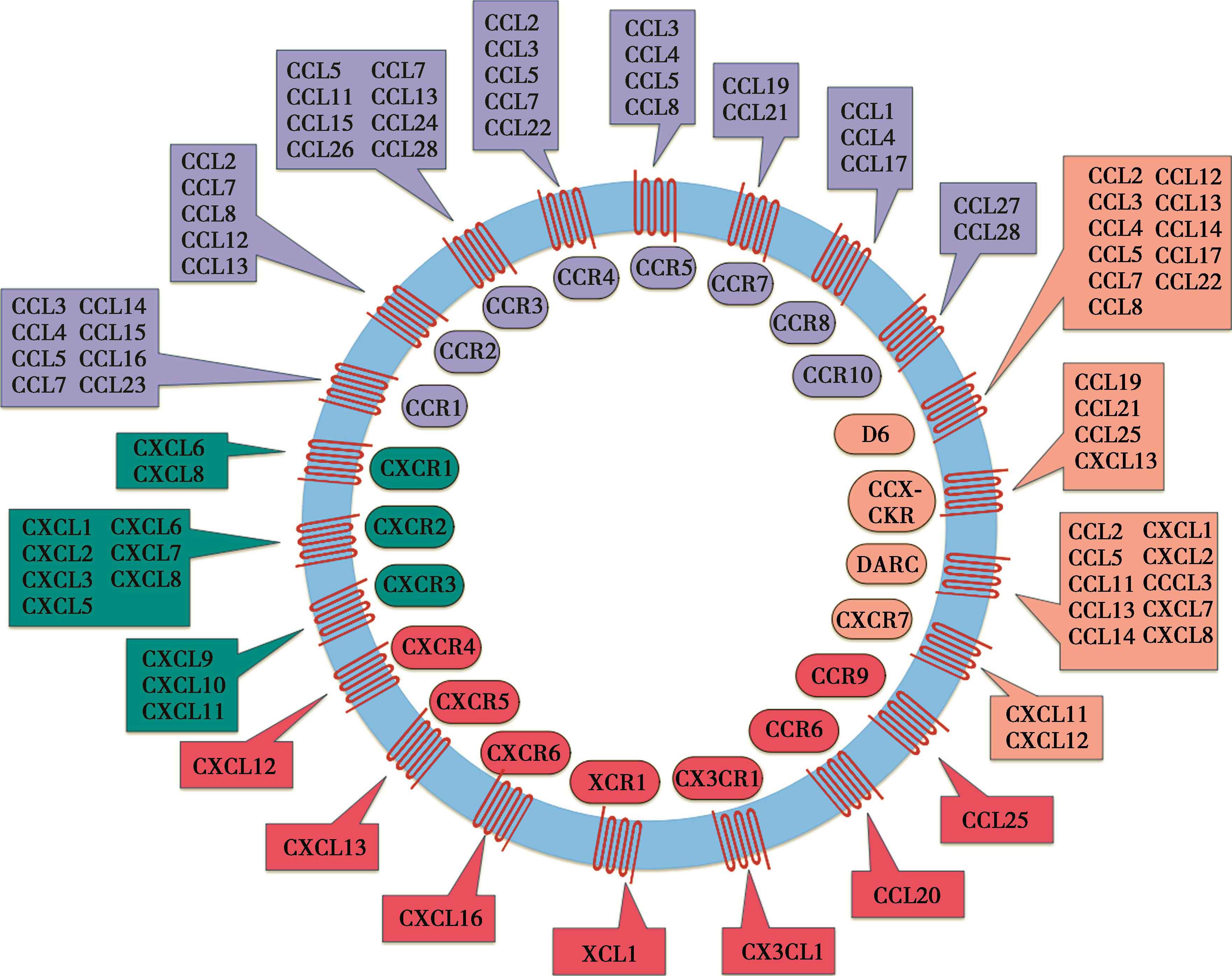
图5-4 趋化因子及趋化因子受体家族
在炎症发生过程中,淋巴细胞通过表达选择素与血管内皮细胞上的选择素受体相互作用,可瞬间非选择性、可逆性地黏附于血管内皮细胞,使淋巴细胞在血流中沿血管壁滚动前行。稳固黏附的淋巴细胞在其分泌的特殊酶的作用下,穿过内皮细胞间隙和基底膜,并在趋化因子浓度梯度的引导下,移行至特定组织中。CXC趋化因子趋化中性粒细胞在炎症部位的聚集对于清除侵入的微生物非常必要。
多种趋化因子参与骨髓中造血祖细胞的发育成熟,如CXCL12可促进B系造血祖细胞增殖,胚胎期动员造血前体细胞迁入骨髓,CXCL12或其特异性受体CXCR4缺陷的小鼠B淋巴细胞发育和成熟障碍。胸腺T细胞的发育包括多个迁移步骤,不同发育阶段由受体表达形式和趋化因子的浓度变化支配,表达定向迁移的趋化因子包括CCL25、CCL17、CCL21、CCL19和CXCL12。趋化因子在淋巴细胞归巢、再循环并在全身各脏器分布和定位过程中也发挥作用,如淋巴结、脾和其他的二级淋巴组织中高表达CCL17、CCL19、CCL21和CCL18,与淋巴细胞表面趋化因子受体CCR7结合可以控制淋巴细胞向二级淋巴组织归巢。
Th1细胞特征性表达CXCR3、CCR2和 CCR5,受趋化因子如 CCL3/MIP-1α、CCL5/RANTES、CXCL9/Mig和CXCL10/IP-10的驱使到达损伤组织,引起Th1型炎症反应;Th2细胞特征性表达CCR3、CCR4、CCR2,可以受趋化因子如 CCL11/eotaxin、CCL7/MCP-2、CCL8/MCP-3、CCL13/MCP-4的驱使而到达损伤组织,引发Th2型炎症反应。