




抗体在临床诊断和疾病防治中的广泛运用,使人们对抗体的需求越来越大,如何大量制备抗体十分关键。人工制备抗体是大量获得抗体的重要途径。人工制备的抗体有三大类,即多克隆抗体、单克隆抗体和基因工程抗体。
多克隆抗体(polyclonal antibody)是早年人工制备抗体的主要方法,采用含有多种不同抗原表位的抗原物质刺激机体,活化多个B细胞克隆。由于所获得的抗血清未经免疫纯化,因此,获得的抗血清实际上是针对多种不同抗原表位的抗体混合物,即多克隆抗体。在体外,多克隆抗体主要来源于动物的免疫血清、恢复期患者血清或接受过免疫接种的人群。其特点是来源广泛、制备容易。在体内,多克隆抗体是机体发挥特异性体液免疫效应的重要效应分子,在中和抗原、免疫调理及介导ADCC中发挥重要作用。
目前,多克隆抗体在临床应用上还存在着一些问题:①由于多克隆抗体是含多种不同抗原表位特异性抗体的混合物,因此特异性不高,常出现交叉反应。②多克隆抗体主要来自动物。现已发现使用动物血清时一些患者常常会产生强烈的免疫应答,即血清病。如果能够使用人血清进行被动免疫当然非常理想,但受人血清的来源限制,不易大量制备,并且十分昂贵,同时人血清的过继应用还有传播疾病的危险。③多克隆抗体制备需要使用大量、纯度要求较高的抗原,因此抗原必须是廉价的并容易获取。④多克隆抗体制备必须通过不断免疫动物获得,不同动物个体对同一种抗原的反应会有差异,结果导致所获得抗体的质量不易控制。这些原因使多克隆抗体的应用受到一定限制。
解决多克隆抗体特异性不高的理想方法是制备单一表位特异性的抗体。单克隆抗体(monoclonal antibody)简称单抗,是指在结构和组成上高度均一、只针对一种抗原表位,其抗原特异性及同种型相一致的一类抗体,具有纯度高、特异性强、效价高、少或无血清交叉反应等特性。
制备单克隆抗体的理想方法是获得只针对单一表位的B细胞克隆,使其在体外扩增并分泌抗体。然而,分泌抗体的浆细胞在体外的寿命较短,也很难培养。1975年,Kohler和Milstein克服了这些困难,建立了体外细胞融合技术,将抗原免疫过的小鼠脾细胞与骨髓瘤细胞融合,获得的杂交瘤细胞具备了既能分泌特异性抗体又能够长期存活的特性(图4-8)。现在,通过杂交瘤细胞技术,我们已经大规模地制备出高特异性的克隆抗体,已广泛应用于疾病的诊断、抗原或蛋白的检测和鉴定、疾病的被动免疫治疗和生物导向药物的制备等。
单克隆抗体有着多克隆抗体不可替代的很多优点:①单克隆抗体用永生的杂交瘤细胞来分泌产生,无需不断免疫动物。一旦获得了目的抗体杂交瘤细胞,便可以在体外长期培养,从细胞培养液中获取抗体,比较方便。②单克隆抗体是针对抗原上单个抗原表位,因而,其特异性强、效价高、少或无血清交叉反应。正是这些优点,单克隆抗体一出现就受到了人们的重视,已成为研究蛋白质结构和功能的重要分子工具之一,并在临床检验上得以广泛应用,有些还被开发成了治疗药物。
尽管单克隆抗体和多克隆抗体在临床检验中得到了广泛的应用,但是它们用于疾病治疗仍有问题需要解决,其中最主要的是动物(小鼠)源性的抗体对人而言为异源蛋白,在人体内直接应用可引起人抗小鼠抗体反应(human anti-mouse antibody response,HAMA)。
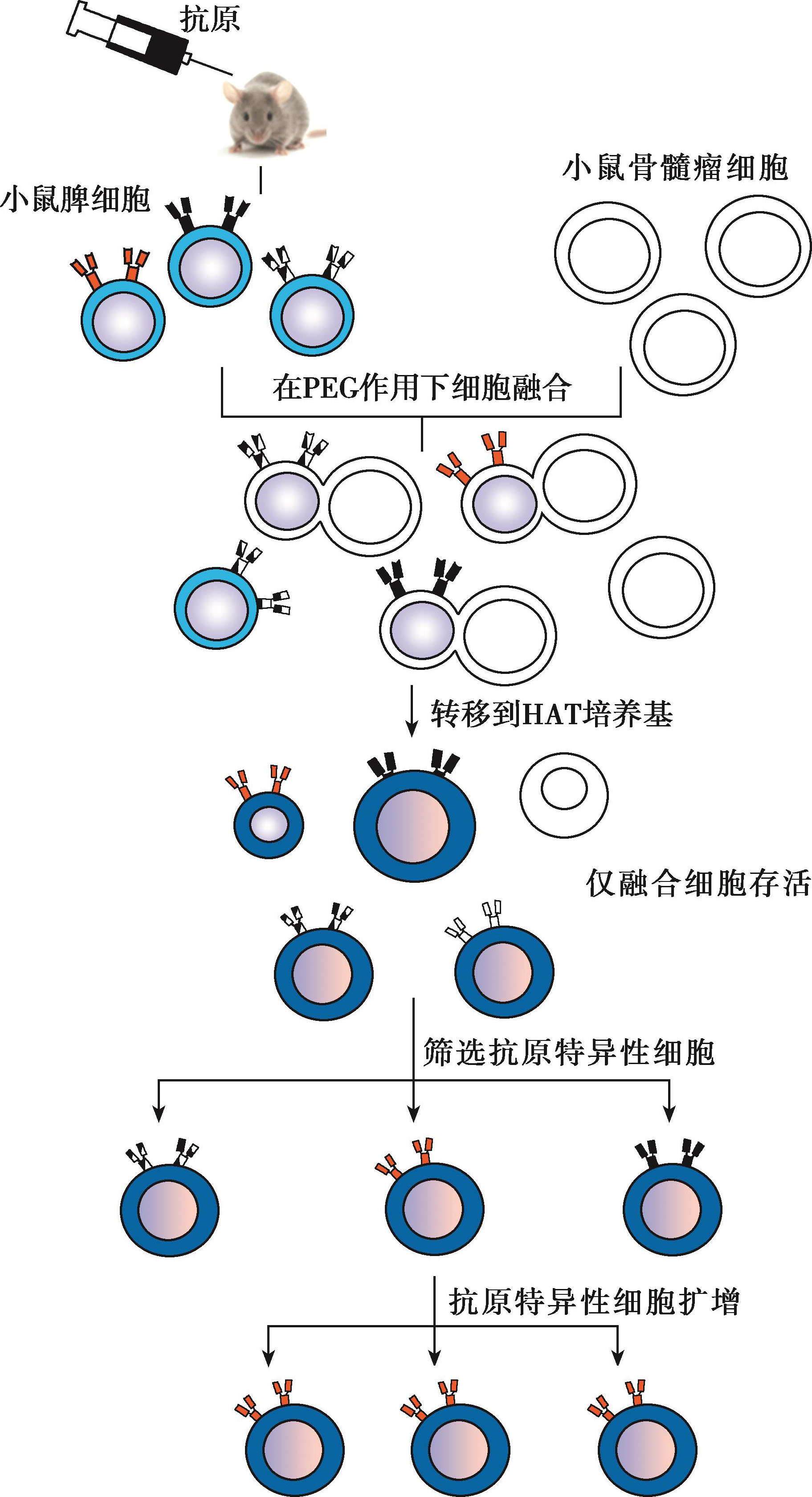
图4-8 单克隆抗体制备示意图
为了解决单克隆抗体异源性这一弊端,人们希望能够将鼠源单克隆抗体逐步实现人源化,减少HAMA。近年来随着基因工程技术的不断发展,学者对鼠源抗体进行拆装和改建,发展出基因工程抗体(genetic engineering antibody),这一希望开始得以实现。基因工程抗体是指利用DNA重组和蛋白工程技术,从基因水平对抗体进行改造和装配,经导入适当的载体细胞后重新表达抗体,并能结合大规模培养的生物反应器,明显提高抗体的产量,据报道可高达500mg/L,甚至利用转基因技术,在动植物个体内表达抗体。基因工程抗体具有以下优点:①降低甚至无排斥反应;②分子量一般比较小,易于穿透血管壁,便于进入病灶的核心部位;③可以根据临床治疗的要求,制备新型抗体;④相对来说,生产成本较低。
制备人源化抗体的主要目的就是在保留原抗体亲和力和特异性的同时,减少抗体的异源性,以利于抗体在临床治疗中应用(图4-9)。
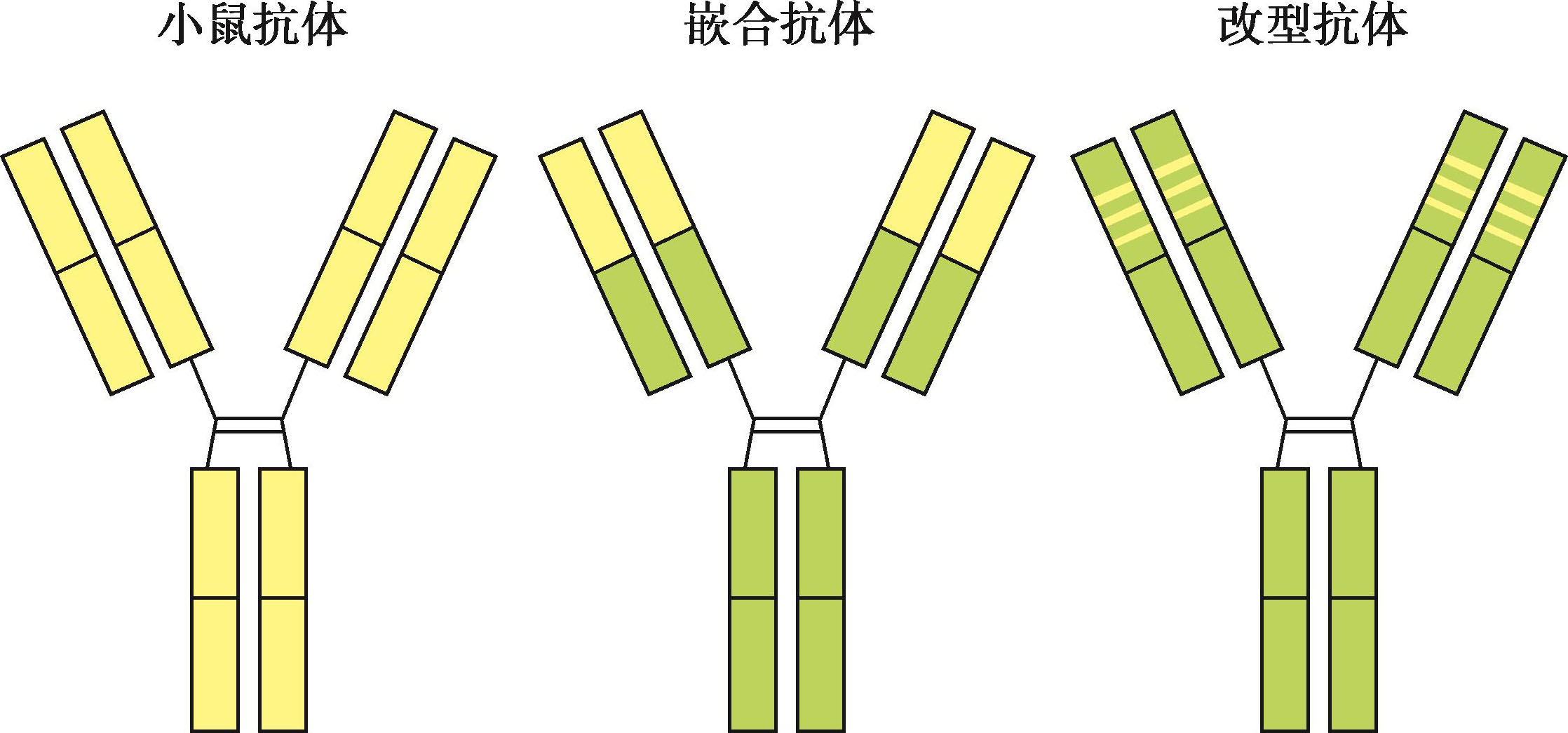
图4-9 小鼠抗体的人源化
嵌合抗体(chimeric antibody)是为了克服鼠源抗体的异种抗原性,将完整抗体分子中的恒定区置换为人源而保留轻重链可变区的抗体,其特点是抗体分子的近2/3部分是人源的,从而大大降低原有单抗中鼠源蛋白的免疫原性。一般来说,嵌合抗体保留了原来鼠源单克隆抗体的特异性和亲和力,HAMA反应虽仍然存在,但大大减弱。此外,置换不同的人恒定区可改变抗体的效应功能。
改型抗体(reshaped antibody)将决定抗体特异性的鼠抗体可变区的CDR部分移植至人源抗体可变区,替代人源抗体CDR部分,使人源抗体获得鼠源单抗的抗原结合特异性,因其主要涉及CDR的“移植”,故也称CDR植入抗体(CDR grafting antibody)。改型抗体中的人源化比例可提高到90%左右,这样就最大限度地降低了鼠抗体的免疫原性。但是许多研究表明,改型后的抗体亲和力较之原抗体下降甚至明显下降,原因可能是虽然抗体的亲和力主要取决于CDR部分,但CDR两段的FR区也常发挥作用,影响CDR的空间构型。因此,为了在抗体改型后仍然保持原有的亲和力,还需要对抗体骨架区加以改进。目前,学者已能对抗体进行分子精细设计,在人源FR区引入鼠源FR区的某些关键残基,如设计得当,其亲和力可与原有小鼠抗体的亲和力相当。制备全人源化抗体是终极目标,但在制备技术上困难较多,仍有待突破。
机体平常所产生的抗体都是单特异性抗体,即抗体只有一个特异性的抗原结合位点,只能特异性与一种抗原结合,再通过Fc部分与细胞表面的Fc受体结合发挥效应作用。有的情况下,需要双特异性抗体,如希望制备一种抗体既能与肿瘤细胞表面的抗原结合,又能激活T细胞去杀伤肿瘤细胞,由于T细胞没有Fc受体,故不能通过与抗体结合直接激活。这种时候,制备一端与肿瘤细胞结合,另一端与T细胞上的分子如CD3结合的双特异抗体,就可以将T细胞激活并杀伤肿瘤。可见双特异性抗体(bispecific antibody,BsAb)是指含有针对两个不同特异性抗原结合位点,可结合两种不同抗原分子的抗体。将两套轻链、重链基因导入骨髓瘤细胞中,选择合适的抗体恒定区及Ig类型,可获得产量大、均一性和高纯度的双特异性抗体。另外,以化学交联技术或杂交-杂交瘤技术也可获得双特异性抗体。
小分子抗体的优点在于:①分子量小,便于穿入细胞;②能在原核细胞中表达,生产容易且成本较低;③不含Fc段,副作用少。小分子抗体包括:
Fab抗体是指由重链Fd(Fd指Fab中约1/2的H链部分,包括VH、CH1和部分铰链区)和完整轻链通过二硫键结合而成的异二聚体,仅含一个抗原结合位点。将重链Fd和完整轻链的编码基因连接,融合细菌蛋白信号肽基因可在大肠杆菌内分泌型表达,形成完整的立体折叠和链内、链间二硫键,保持Fab片段的功能。
Fv(fragment of variable,Fv)抗体是指由VH和VL通过非共价键结合形成的单价小分子。
单链抗体(single chain fragment variable,ScFv)是指轻链和重链可变区基因经适当的寡核苷酸接头连接形成的多肽链。多肽链能自发折叠成天然构象,保持Fv的特异性和亲和力。
单区抗体(single domain antibody,SdAb)是指将抗体重链可变区通过基因工程方法表达,获得仅含重链可变区片段的抗体。单区抗体与抗原结合的能力及其稳定性,与完全抗体基本一致。单区抗体大小仅为完整IgG分子的1/12,更容易进入细胞,到达完整抗体所不能到达的地方。
既然鼠抗体人源化技术难度很大,那么能不能在没有鼠抗体的情况下直接制备人源抗体呢?这样就避免了使用鼠源抗体的种种弊端。从20世纪90年代人们开始希望利用基因工程的技术直接制备人源抗体,噬菌体展示技术(phage display technology)是其中一种重要的方法。
该技术用噬菌体基因作为载体,通过PCR从人免疫细胞中获取整套的抗体VH和VL基因(抗体库),克隆到噬菌体外壳蛋白结构基因的适当位置,使抗体库基因随外壳蛋白的表达而表达,这样噬菌体DNA中有抗体基因的存在,并表达抗体分子,然后通过抗原-抗体特异性结合的方法筛选出所需要的抗体,并进行克隆扩增。目前最常使用的载体来自丝状噬菌体(filament phage)。抗体库的VH和VL基因可以从免疫过的、没有免疫过的人淋巴细胞或人工合成的渠道得到。
该技术的特点包括:①噬菌体展示技术中所使用抗体库的外源基因来自人体外周血、骨髓或脾脏的淋巴细胞,模拟天然全套抗体库,包含B细胞全部克隆;②由于抗体库的大容量和极高的筛选效率,使得可以从抗体库中筛选任意抗体基因,然后利用基因工程方法制备抗体,从而避免了使用人工免疫动物和细胞融合技术;③在噬菌体抗体库技术中,抗体库基因来源于人,另外, VH 和 VL 基因的随机重组模拟了体内抗体亲和力成熟的过程,因此,该技术可获得高亲和力的人源化抗体。
基因工程抗体的另外一个重要研究领域是通过改进抗体的功能来满足实际工作的需要。如将抗体的Fab段与一些具有杀伤功能的分子如酶、毒素、细胞因子、放射性放射性核素或药物相连形成所谓的生物导弹,其中抗体的Fab段主要发挥定向指引作用,将所携带的具有杀伤功能的分子定向定点结合靶细胞,并通过所携带的效应分子对靶细胞进行杀伤。这样可以更有效地发挥生物活性物质的功能,减少其副作用。