




Steinman和Cohn于1973年首次在小鼠脾脏中发现了具有树枝状突起的、形态独特的细胞,并将之命名为树突状细胞(dendritic cell,DC)。DC是目前公认的功能最强大的专职抗原呈递细胞。其能有效地激活初始T细胞(naïve T cell),是机体适应性免疫应答的始动者。
成熟DC表面具有许多树枝状突起,细胞质无溶酶体和吞噬体,其他细胞器也少见,胞核形状不规则。DC共同的表面标志是Flt3受体,组成性地表达MHC-Ⅰ类和MHC-Ⅱ类分子,共刺激分子(CD80、CD86等)、黏附分子[CD40、CD54(ICAM-1)等]、与吞噬有关的受体[如Fc受体、补体受体、甘露糖受体(MR)和Toll样受体(TLR)等]和β1、β2整合素等。此外,DC还有一些相对特异性的标志,如人类DC表达CD1a、CD11b、CD11c、CD83、血液树突状细胞抗原(BDCA2和BDCA4)和锌指蛋白46(Zbtb46)等,小鼠DC表达CD11b、CD8αα和Zbtb46等,但目前尚未发现专一性的DC表面标志物。
体内所有的DC均起源于骨髓CD34 + 造血前体细胞。DC广泛分布于全身多种脏器,但其数量很少,约占人外周血单个核细胞中1%。DC主要分为两大类:一类是由共同淋巴系前体细胞(common lymphoid progenitor,CLP)分化而来的浆细胞样DC(plasmacytoid dendritic cell,pDC);另一类是由骨髓中共同髓系前体细胞(commonmyeloid progenitor,CMP)分化而来的经典DC(classical dendritic cell,cDC)。cDC的主要功能是诱导针对入侵抗原的特异性免疫应答和维持自身耐受。pDC的主要功能是借助于胞质内的TLR7和TLR9感知病毒DNA或RNA,并通过信号转导产生大量的Ⅰ型干扰素,介导细胞免疫,发挥抗病毒作用(表2-4)。
表2-4 cDC和pDC的主要特点

骨髓的髓系前体具有分化为巨噬细胞、粒细胞以及在GM-CSF的作用下分化为DC的潜能。在体外,人外周血单核细胞在GM-CSF和IL-4存在的条件下可被诱导分化为DC,这些均证明了DC的髓系起源。由CMP产生的髓样DC被命名为传统 DC(conventional dendritic cell)或经典DC(classical dendritic cell),简称cDC,与单核/巨噬细胞和粒细胞属于同一谱系。
一些位于淋巴组织内的DC,如胸腺内的DC以及小鼠脾脏、淋巴结内的某些DC亚群表达与淋巴细胞相关的表面标志,如CD8α、CD4、CD2、BP1、CD25等,提示这些DC为淋巴系起源。从共同淋巴系前体细胞分化而来的 DC,称为淋巴样 DC(lymphoid dendritic cell,LDC)或浆细胞样DC(plasmacytoid dendritic cell,pDC),简称为pDC,与T细胞、B细胞和NK细胞属于同一谱系(图2-9)。
分为四个阶段,即前体阶段、未成熟阶段、迁移阶段、成熟阶段。
cDC在血液中有两类前体细胞:①CD14 + CD11c + CD1 - 单核细胞,可在GMCSF、IL-4的诱导下分化为DC;②CD14 - CD11c + CD1 + 细胞,可在GM-CSF、IL-4和TGF-β诱导下分化为朗格汉斯细胞。
稳态条件下,体内绝大多数的DC处于未成熟状态,这些未成熟DC(imDC)基本特征为:①高表达补体受体、Fc受体、甘露糖受体和TLR,分泌TNF-α、IL-1、IL-6等细胞因子,可通过受体介导的内吞作用、吞噬和胞饮作用摄取和加工抗原;②低表达MHC-Ⅱ类分子、共刺激分子(CD80、CD86等)和ICAM等黏附分子,呈递抗原刺激初始T细胞活化的能力很弱,可参与诱导免疫耐受。
imDC一旦接触并摄取抗原或受炎症因子等影响,即开始从非淋巴组织向外周淋巴器官迁移。迁移过程中,imDC逐渐成熟,其抗原摄取能力逐渐下降,而呈递抗原并刺激初始T细胞活化的能力则逐渐增强。
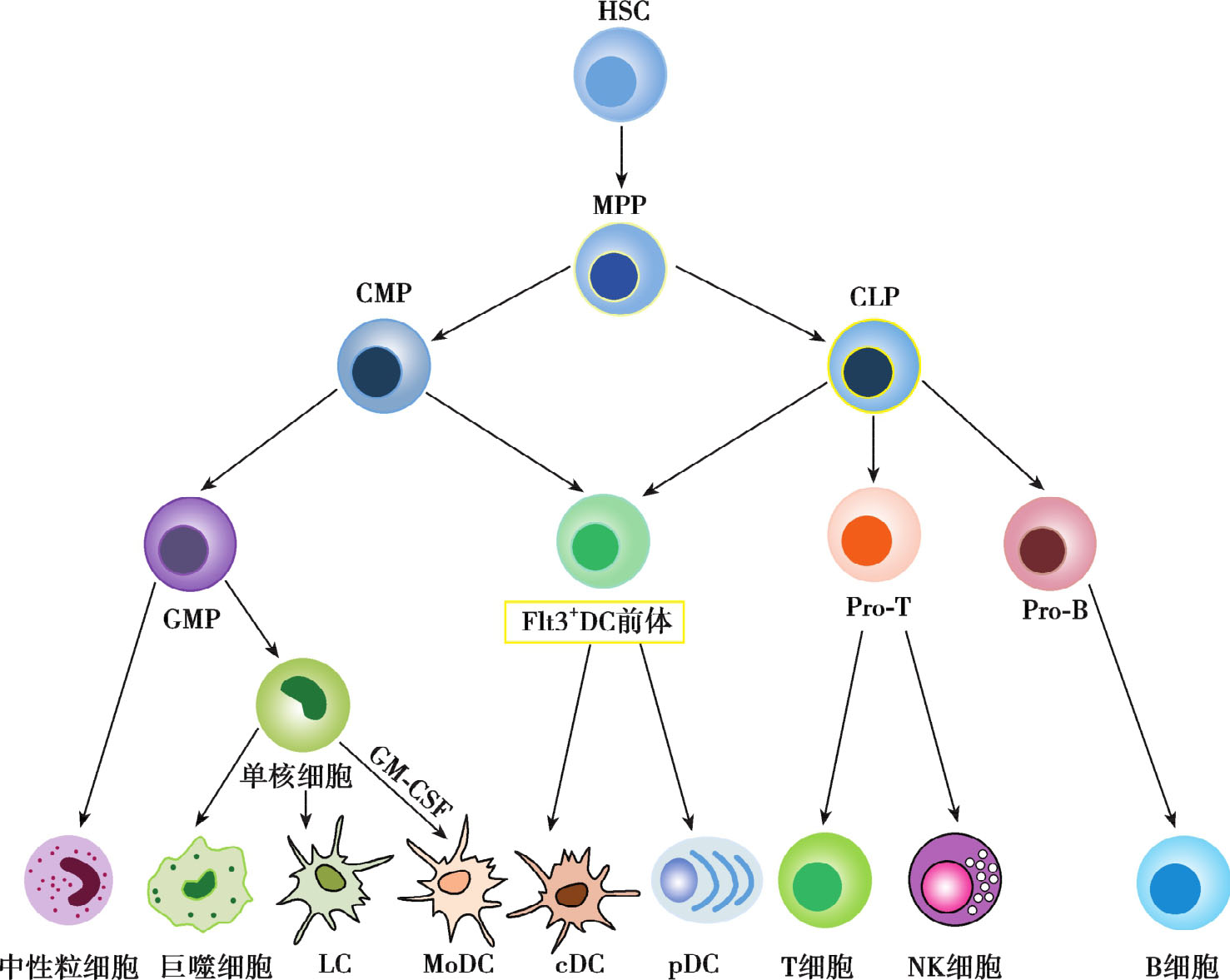
图2-9 DC的来源
cDC和pDC均可由表达Flt3的共同髓系或淋巴系前体细胞产生。其中,cDC与单核/巨噬细胞属于同一谱系,pDC与T细胞、B细胞和NK细胞属于同一谱系。血液中单核细胞迁移至组织后可分化为巨噬细胞或朗格汉斯细胞(LC),且单核细胞在GM-CSF存在下也可分化为具有cDC基本特性的MoDC
成熟DC(mDC)高表达MHC-Ⅰ/Ⅱ类分子、共刺激分子、CD54、CD1a和CD83,不表达FcR和补体受体,主要分泌IL-12等细胞因子,具有很强的抗原呈递和激活初始T细胞的能力。
CD14 - CD11C - CD123(IL-3Rα) + pDC前体细胞在IL-3的刺激下可以分化为未成熟pDC,在IL-3和CD40L的共同刺激下可分化为成熟pDC。此外,pDC前体细胞还可在病毒作用下分化成熟并产生大量的Ⅰ型干扰素。研究表明,CLP和CMP中Flt3 + 细胞都有可能分化为pDC,Ⅰ型干扰素与Flt3L联合促进pDC的发育、分化。分化成熟的pDC进入外周循环,在淋巴结中的T细胞聚集区定居。
DC广泛分布于脑组织以外的全身多种脏器,一般可分为两大类,即pDC和cDC。根据DC来源、分布、分化状态和功能等,又可将其分为不同的类别。
主要分为髓样DC和淋巴样DC。
按其组织分布可分为3类:①淋巴样组织DC,包括滤泡DC、并指状DC和胸腺DC;②非淋巴样组织DC,包括朗格汉斯细胞和间质DC;③循环DC,包括外周血DC和隐蔽DC。
滤泡状树突状细胞(follicular dendritic cell,FDC)是参与再次免疫应答的主要抗原呈递细胞,主要分布于淋巴结、脾脏和肠相关淋巴组织B细胞区的初级和次级淋巴滤泡中,不具有迁移性。FDC不表达MHC-Ⅱ类分子,高表达FcR和补体受体,可有效地捕获抗原-抗体复合物和(或)抗原-抗体-补体复合物。FDC参与记忆性B细胞的产生和维持。
并指 DC(interdigitating DC,IDC)是参与初次免疫应答的重要APC,由皮肤朗格汉斯细胞移行至淋巴结衍生而来,定位于淋巴组织胸腺依赖区和胸腺髓质区,其表面缺乏C3bR和Ig受体,但表达高水平的MHC-Ⅰ类和Ⅱ类分子,可有效地将抗原信息传递给T细胞。多数IDC易发生凋亡,寿命短,少数长寿的IDC可能参与T细胞免疫记忆的维持。
胸腺树突状细胞(thymic dendritic cell)即胸腺并指状细胞。人类胸腺DC高表达自身抗原、MHC-Ⅱ类分子和CD11,其主要功能是参与T细胞在胸腺的阴性选择。
朗格汉斯细胞(Langerhans cell,LC)是位于表皮和胃肠上皮组织的未成熟DC,表面高表达FcγR、C3bR、MR和TLR,中等表达MHC-Ⅰ类和Ⅱ类分子,胞质中含有特征性Birbeck颗粒。LC具有较强的吞噬能力和抗原呈递能力。
间质树突状细胞(interstitial DC)主要是分布在心、肝、肾和肺等器官结缔组织中的未成熟DC,表面高表达MHC-Ⅱ类分子,具有不规则膜突起。
循环树突状细胞(circulating DC)包括两大类:①外周血DC,主要为来自骨髓的DC前体细胞、经血液循环迁移携带抗原的LC和间质DC;②隐蔽DC(veiled cell,VC),为输入淋巴管和淋巴液中迁移形式的DC,分布于全身淋巴管中。在感染、损伤等刺激下,全身各器官DC均迁移至淋巴管中形成VC。VC具有较强的抗原摄取能力,可激活初始T细胞,启动初次免疫应答。
主要分为DC前体细胞、未成熟DC和成熟DC(见上文)。
依据DC的功能不同,将其分为耐受性DC和调节性DC。
即具有诱导免疫耐受功能的DC。主要包括表达吲哚胺2,3二氧化酶(indoleamine 2,3-dioxygenase,IDO)的DC、高表达免疫球蛋白样转录物(immunoglobulinlike transcript 4,ILT4)的DC和未成熟的DC。
保留抗原呈递能力,低表达共刺激分子(CD80、CD86和CD40)和IL-12,上调抑制分子(PDL1、CD95L、IDO)和抗炎因子(TGF-β、IL-10)的表达。调节性DC能诱导T细胞无能、Treg产生和抑制T细胞应答。
DC是体内最重要的专职APC,负责抗原的摄取、加工和呈递,诱导机体产生特异性的免疫应答。
微生物特别是病毒感染能够刺激pDC快速分泌大量的Ⅰ型干扰素和IL-6、IL-8和TNF-α等细胞因子,从而激活T细胞、NK细胞和巨噬细胞。
pDC可通过以下两条途径分化为具有cDC特征的细胞,从而获得直接与T细胞相互作用的能力。
pDC高表达IL-3受体,可在含IL-3和CD40L的培养体系中分化为具有cDC特征的细胞。
pDC表达TLR7和TLR9,病毒或人工合成的CpGODN可以刺激pDC产生IFN-α和TNF-α,从而诱导pDC分化为具有cDC特征的细胞。
pDC来源的具有cDC特征的细胞既能通过IFN-α途径(而不是IL-12)诱导Th1免疫应答,又能通过OX40L途径诱导Th2型免疫应答。
TLR9配体、CD200R和CD40L活化pDC后,可通过多条途径(如表达IDO和颗粒酶B)诱导产生Treg细胞、诱导T细胞无能和抑制T细胞活化,从而诱导免疫耐受。
成熟的cDC表达高水平的MHC-Ⅰ类和MHC-Ⅱ类分子,具有极强的呈递能力,其呈递抗原的途径主要有以下三条:①cDC摄入的内源性抗原多数通过内源性抗原加工呈递途径,以抗原肽-MHC-Ⅰ类复合物的形式呈递给CD8 + T细胞;②cDC摄入的外源性蛋白质抗原多数在富含MHC-Ⅱ类分子的MHC-Ⅱ类小室中被降解成多肽,并与MHC-Ⅱ类分子结合为复合物而表达于DC表面,呈递给CD4 + T细胞;③DC摄取的外源性脂类或糖脂类抗原主要通过CD1途径被加工和呈递。
cDC通过抗原呈递为初始T细胞的活化提供抗原刺激信号(第一信号),同时其表面高表达的共刺激分子B7能够与T细胞表达的CD28分子结合,为T细胞的活化提供第二信号。此外,Th细胞的分化可促进B细胞的成熟和抗体的产生。
cDC分泌IL-12促进Th0细胞向Th1细胞分化,同时通过分泌IL-4参与Th0细胞向Th2细胞分化。
cDC在诱导和维持机体免疫耐受中发挥重要的作用。主要包括两个方面:①在胸腺中,DC通过清除自身反应性T细胞诱导中枢耐受;②cDC通过多种途径诱导外周耐受。
DC通过分泌IL-4参与Th0细胞向Th2细胞分化,辅助B细胞的活化。DC还可以通过分泌可溶性gp80,促进记忆性B细胞分化为浆细胞产生IgG。
DC是连接天然免疫和获得性免疫的桥梁,除了对获得性免疫应答具有重要的触发和调控作用外,还可以通过分泌大量的细胞因子,对天然免疫产生重要的影响。例如,DC分泌的IL-12、IL-15、IL-18等细胞因子可促进NK细胞和单核细胞的活化。
DC参与多种疾病(如感染、肿瘤、自身免疫疾病以及移植排斥)的发生和发展。其功能具有巨大的可塑性,既可以发挥免疫激活作用,又能够诱导免疫耐受。
DC在感染性疾病中具有双重作用。一方面,作为最强的APC,DC在病原体抗原的摄取、加工、呈递和介导特异性抗感染免疫应答中具有重要的作用。因此,可以应用病原体抗原体外致敏DC再过继回输的方式治疗感染性疾病。另一方面,DC可导致病毒的复制、播散和免疫抑制,例如DC是HIV感染的重要靶细胞和病毒储存物,HIV可在DC与CD4 + T细胞的集合区进行复制,并感染T细胞。如何发挥DC抗感染能力、阻断病毒感染DC而导致的病毒复制和免疫抑制,具有重要的研究和应用价值。
在移植免疫中,供者的未成熟DC倾向于诱导免疫耐受,而成熟DC则倾向于引发免疫排斥。因此,预先去除移植物中的成熟DC或用未成熟DC诱导同种免疫耐受,可提高移植的成功率。
DC疫苗和以DC为基础的基因治疗在抗肿瘤治疗中发挥着重要的作用。应用肿瘤细胞冻融物、肿瘤蛋白抗原或人工合成的肿瘤抗原多肽,体外冲击致敏DC,制备肿瘤疫苗,或将肿瘤抗原基因通过腺病毒、反转录病毒载体等转入DC,使DC内源性的表达肿瘤抗原表位并通过MHC-Ⅰ类分子呈递是目前肿瘤生物治疗的重要手段。将肿瘤抗原体外致敏的DC回输到患者体内,能有效地诱导产生肿瘤抗原特异性的CTL,从而杀伤肿瘤细胞。基于DC基础的抗肿瘤疗法,目前已应用于黑色素瘤、B淋巴瘤、前列腺癌、多发性骨髓瘤、肾癌等患者的治疗。
DC调控着免疫应答和免疫耐受间的平衡,因此DC稳态的改变可能会引起一些自身免疫病的发生。持续的DC活化可能会通过自身抗原的呈递使自身免疫耐受向自身免疫应答转变,进而导致自身免疫性疾病的发生。如在SLE发病机制研究中发现,SLE患者受累的器官中存在大量的pDC,其血清和皮损部位可检测到IFN-α表达上升,可能的机制是:pDC在自身抗体和DNA-抗体免疫复合物的刺激下持续产生IFN-α。因此,可以通过抑制pDC产生IFN-α的手段使SLE得到缓解。