





(1)理解标准溶液的两种配制方法。
(2)熟悉标定盐酸溶液常用的基准物质。
(3)学习减量法称量操作,进一步练习滴定分析的基本操作。
盐酸作为一种挥发性酸是不能采用直接法配制标准溶液的,实验3中我们已经配制了浓度近似为0.1mol·L -1 HCl溶液,本实验以Na 2 CO 3 作为基准物质来标定盐酸溶液的浓度。Na 2 CO 3 是二元碱,与盐酸反应时有两个化学计量点,第一化学计量点(pH≈8.3)和第二化学计量点(pH≈3.9),相对于第一化学计量点附近的突跃,第二化学计量点附近的突跃比较明显,因此可选用甲基橙作为指示剂。但要注意滴定过程中要不断摇动锥形瓶以驱除反应生成的CO 2 ,防止终点提前到达。
当以甲基橙为指示剂时,碳酸钠与盐酸反应如下:
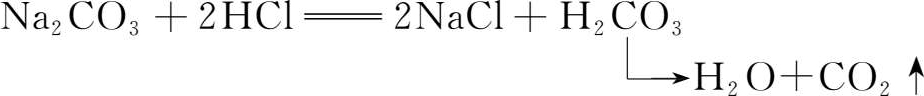
当盐酸和碳酸钠完全反应时,“等物质的量关系”为:
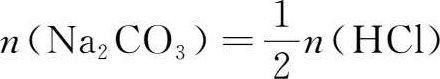
而
n
(Na
2
CO
3
)=
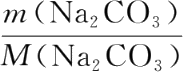 ,
n
(HCl)
=c
(HCl)·
V
(HCl),所以有:
,
n
(HCl)
=c
(HCl)·
V
(HCl),所以有:
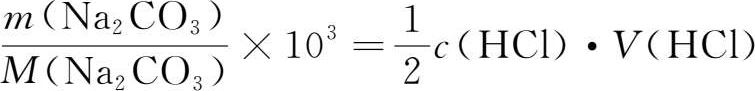
即:
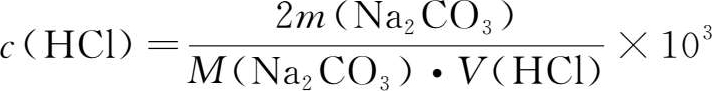
式中: c (HCl)为盐酸浓度,mol·L -1 ; m (Na 2 CO 3 )为Na 2 CO 3 质量,g; M (Na 2 CO 3 )为Na 2 CO 3 摩尔质量,g·mol -1 ; V (HCl)为滴定消耗盐酸体积,mL。
量筒,酸式滴定管,0.1mg分析天平,称量瓶,锥形瓶。
浓盐酸(密度1.19g·mL -1 ),0.1%甲基橙水溶液,Na 2 CO 3 (分析纯,在270℃下干燥2~3h,贮于干燥器中)。

视频:盐酸浓度的标定
参见实验3。
用“减量法”准确称量0.11~0.15 g已烘干的无水碳酸钠基准物质至锥形瓶中,加25mL蒸馏水溶解,同时加1滴0.1%甲基橙指示剂,用欲标定的HCl溶液滴定至溶液由黄色刚好变橙色即为终点,临近终点时注意剧烈摇动锥形瓶以驱除反应生成的二氧化碳,记录滴定时消耗的HCl体积,平行测定三次,要求三次测定结果相对平均偏差≤0.2%,否则应重做。
(1)标定HCl溶液的物质除了用Na 2 CO 3 外,还可以用何种基准物质?写出有关反应并列出“等物质的量关系”。
(2)实验中称取Na 2 CO 3 基准物质质量为0.11~0.15g,其依据是什么?
(3)盛放Na 2 CO 3 的锥形瓶是否需要预先烘干?加入的水量是否需要十分准确?