





化学实验中需要测量各种物理量和参数,在测定过程中,不仅要经过许多操作步骤,使用多种仪器和化学试剂,而且还受到测定者本身的各种因素的影响,使得测量结果和真实值之间或多或少有一些差距,这就是误差。根据误差产生的原因不同,可将误差分为系统误差、随机误差和过失误差。
系统误差又称可测误差或恒定误差。在分析测定工作中系统误差产生的原因主要有:方法误差、仪器和试剂误差、人员误差、环境误差等。
(1)方法误差
方法误差又称理论误差,是由测定方法本身造成的误差,或是由于测定所依据的原理本身不完善而导致的误差。例如,在重量分析中,由于沉淀的溶解、共沉淀现象、灼烧时沉淀分解或挥发等;在滴定分析中,反应进行不完全或有副反应、干扰离子的影响等,使得滴定终点与理论等当点不能完全符合,如此等等原因都会引起测定的系统误差。
(2)仪器和试剂误差
仪器误差也称工具误差,是测定所用仪器不完善造成的。分析实验中所用的仪器主要指基准仪器(天平、玻璃量具)和测定仪器(如分光光度计、pH计等)。
天平是分析测定中最基本的基准仪器,如天平不等臂、灵敏度欠佳、砝码失于校准等会产生称量误差,应由计量部门定期进行检校。
市售的玻璃量具(容量瓶、移液管、滴定管、比色管等),其真实容量并非完全与其标称的容量相符,对一些要求较高的分析工作,要根据容许误差范围,对所用的仪器进行容量校准。
分析所用的测定仪器,要按说明书进行校准。在使用过程中应随时进行检查,以免发生异常而造成测定误差。
试剂误差是由于试剂不纯和蒸馏水中含有微量杂质所引起的。
由试剂、蒸馏水、实验器皿和环境带入的杂质所引起的系统误差,可以通过做空白试验来消除或减小。空白试验是在不加试样的情况下,按照试样的分析步骤和条件而进行分析的试验。得到的结果称为“空白值”。从试样分析结果中扣除空白值,就可以得到更接近于真实含量的分析结果。
(3)人员误差
人员误差是由于测定人员的判断能力、反应速度和固有习惯引起的误差。这类误差往往因人而异,因而可以采取让不同人员进行分析,以平均值报告分析结果的方法予以减小。
(4)环境误差
环境误差是由于测定环境所带来的误差。例如室温、湿度不是所要求的标准条件,测定时仪器受震动和电磁场、电网电压、电源频率等变化的影响,室内照明影响滴定终点的判断等。在实验中如发现环境条件对测定结果有影响时,应重新进行测定。
随机误差指在实际相同的条件下,对同一样品进行多次测定时,单次测定值与真实值之间差异的绝对值和符号均无法预计的误差。这种误差是由测定过程中各种随机因素的共同影响造成的。因此,随机误差的数值和方向不定,有大有小,时正时负。从表面上看,这类误差似乎没有规律性,但若对随机误差进行统计分析,发现:绝对值小的误差比绝对值大的误差出现的次数多;在一定条件下得到有限次测定值中,其误差的绝对值不会超过一定的界限;在测定的次数足够多时,绝对值相近的正误差与负误差出现的次数大致相等,此时正负误差相互抵消,随机误差的绝对值趋向于零。分析工作者通常采用平均值报告分析结果时,正是运用了这一概率定律。在排除了系统误差的情况下,用增加测定次数的办法,使平均值成为与真实值较吻合的估计值。
过失误差也称粗差。这类误差明显地歪曲测定结果,是由于在测定过程中犯了不应有的错误造成的。例如,标准溶液超过保存期,浓度或价态已经发生变化而仍在使用;器皿不清洁;不严格按照分析步骤或未正确按分析方法进行操作;弄错试剂或吸管;试剂加入过量或不足;操作过程中试样受到大量损失或污染;仪器出现异常未被发现;读数、记录及计算错误等,都会产生过失误差。过失误差无一定的规律可循,这些误差基本上是可以避免的。消除过失误差的关键,在于分析人员必须养成专心、认真、细致的良好工作习惯,不断提高理论和操作技术水平。
在实际工作中,分析结果的数据处理非常重要。分析工作者仅做1~2次测定是不可能提供可靠信息的,也不会被人们接受。因此在科研和实验工作中,应该对试样进行多次平行测定,直至获得足够的数据,然后进行统计处理。个别数据可能与其他数据偏离较远,这些数据叫作可疑值或逸出值。对分析结果要求比较高的情况下,需要对可疑值进行取舍。
一般按照Q检验法对可疑值进行取舍,此法适用于3~10次测定时的数据处理。
基本步骤如下:
①数据按从小到大顺序排列: x 1 , x 2 , x 3 ,…, x n ,其中 x 1 为最小值, x n 为最大值;
②找出可疑值 x 1 或 x n ;
③求出Q 计 :
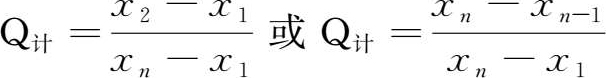
④查附表13得到Q 表 值;
⑤若Q 计 >Q 表 ,则此值舍去,否则应保留。
【例1-1】 某一含氯的试样,四次测定的结果分别为30.22%、30.34%、30.42%、30.38%。此实验数据中30.22%是否舍去(90%置信度)?
将四次测定结果按从小到大顺序排列:30.22%、30.34%、30.38%、30.42%,其中30.22%为可疑值。
解:Q
计
=
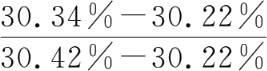 =0.60,查附表13得Q0.90=0.76
=0.60,查附表13得Q0.90=0.76
Q 计 =0.60<Q0.90=0.76,不舍去。

视频:有效数字及运算规则
在科学实验中,为了得到准确的测定结果,不仅要准确地测定各种数据,而且还要正确地记录和计算。分析结果的数值不仅表示试样中被测组分含量的多少,而且还反映了测定的准确程度。所以,记录数据和计算结果应保留几位数字是很重要的。
数字的位数不仅表示数字的大小,也反映测量的准确程度。所谓有效数字,就是指实际能测得的数字。
有效数字保留的位数,应根据分析方法与仪器的准确度来决定,一般使测得的数值中只有最后一位是可疑的。例如在分析天平上称取试样0.8000 g,这不仅表明试样的质量为0.8000g,还表明称量的误差在±0.0001g以内。如将其质量记录成0.8g,则表明该试样是在台称上称量的,其称量误差为±0.1g,故记录数据的位数不能任意增加或减少。
有效数字就是保留最后一位不准确数字,其余数字均为准确数字。同时从上面的例子也可以看出有效数字是和仪器的准确程度有关,即有效数字不仅表明数值的大小而且也反映测量的准确度。
对于滴定管、移液管和吸量管,它们都能准确测量溶液体积到0.01 mL。所以当用50mL滴定管测定溶液体积时,如测量体积大于10mL小于50mL时,应记录为4位有效数字,例如写成24.22mL;如测定体积小于10mL,应记录3位有效数字,例如写成8.13mL。当用25 mL移液管移取溶液时,应记录为25.00mL;当用5mL吸量管取溶液时,应记录为5.00mL。当用250mL容量瓶配制溶液时,所配溶液体积应记为250.00mL。当用50mL容量瓶配制溶液时,应记录为50.00mL。
总而言之,测量结果所记录的数字,应与所用仪器测量的准确度相适应。
“0”在有效数字中有两种意义:一种是作为数字定值,只表示小数点的位置;另一种是有效数字。数字中间的“0”和末尾的“0”都是有效数字,而数字前面所有的“0”只起定值作用。以“0”结尾的正整数,有效数字的位数不确定。例如1800这个数,其有效数字位数,可能为2位、3位、4位(或无数位)。遇到这种情况,应根据实际有效数字书写成:
1.8×10 3 2位有效数字
1.80×10 3 3位有效数字
1.800×10 3 4位有效数字
因此很大或很小的数,常用10的乘方表示。当有效数字确定后,在书写时一般只保留一位可疑数字,多余数字按数字修约规则处理。
我国科学技术委员会正式颁布的《数字修约规则》,通常称为“四舍六入五成双”法则。即当尾数≤4时舍去,尾数≥6时进位。当尾数为5时,则应视5前面的数字是奇数还是偶数,若是偶数应将5舍去,若是奇数应将5进位;若5的后面还有不为“0”的任何数,则此时无论5的前面是奇数还是偶数,均应进位。
(1)加减法
在加减法运算中,保留有效数字以小数点后位数最小的为准,即以绝对误差最大的为准。
(2)乘除法
乘除运算中,保留有效数字的位数以有效数字位数最少的数为准,即以相对误差最大的为准。
(3)自然数法
在分析化学中,有时会遇到一些倍数和分数的关系,如:
H 3 PO 4 的相对分子量/3=98.00/3=32.67
水的相对分子量=2×1.008+16.00=18.02
在这里分母“3”和“2×1.008”中的“2”都不能看作是一位有效数字。因为它们是非测量所得到的数,是自然数,其有效数字位数可视为无限。
实验中直接观察得到的数据称为原始数据,它们应该直接记录在实验记录本上,不允许随意更改和删减。数据记录的格式可采用表格式。记录数据的有效数字位数应与所用仪器的最小读数相适应。实验结束后,应将实验数据仔细复核,报告指导教师后方可离开实验室。
实验数据可用列表法、图解法等方式进行处理。化学分析数据常用列表法处理,其形式最为简洁。仪器分析数据常用图解法处理,比较简明直观。
(1)列表法
列表法在一般化学分析实验中应用最为普遍,特别是原始实验数据的记录,简明方便。其方法是:在表格的上方标明实验的名称,表的横向表头列出实验号,纵向表头列出数据的名称,通常按操作步骤的顺序排列。
(2)图解法
许多仪器分析法常用图形来表述实验结果,用图解法表述测量数据之间的关系往往比用文字表述更简明直观。它可用于以下情况:
①用变量间的定量关系图求未知物含量,如外标法的标准曲线;
②通过曲线外推法求值,如将标准加入法的工作曲线外推求待测物的含量;
③求函数的极值或转折点,如利用可见-紫外吸收曲线找到最大吸收波长和计算摩尔吸光系数等;
④图解积分和微分,如色谱图上的峰面积等。
(1)实验记录本与实验预习报告本共用,要将本子编上页码。
(2)实验过程中的各种测量数据及有关现象应及时、准确而清楚地记录。

视频:Excel在数据处理中的应用
(3)实验过程中涉及的各种特殊仪器的型号和标准溶液浓度等,也应及时准确记录下来。
(4)要有严谨的科学态度,实事求是,切忌夹杂主观因素,决不能随意拼凑和伪造数据。
(5)记录实验过程中的数据时,应注意根据测量仪器的精度来确定有效数字的位数。
(6)实验记录上的每一个数据都是测量结果。所以,重复测定时,即使数据完全相同时也应记录下来。
(7)发现数据算错、测错或读错而需要改动时,可将该数据用一横线划去,并在其上方写上正确的数字。
(8)实验结果应以多次测定的平均值表示,同时还应给出测定结果的置信区间或标准偏差。
实验报告是对实验的提炼、归纳和总结,能进一步消化所学的知识、培养分析问题的能力。因此要重视实验报告的书写。
实验报告应先注明实验编号、实验名称、实验日期,根据具体实验的要求,还可记录实验时的温度及湿度等,然后按照下列内容写出实验报告。
(1)实验目的:简要说明本实验的目标和要求。
(2)实验原理:扼要叙述实验相关的原理,用文字和反应式表示。
(3)实验内容:应简明扼要,可用流程图表示。
(4)实验数据及处理:可用表格、图形将数据表示出来,并按一定公式计算出分析结果和分析结果精密度等。
(5)问题及讨论:对实验中观察到的现象及实验结果进行分析和讨论。若实验失败,应寻找失败原因,总结经验教训,以提高自己实验操作的能力。

样例:实验报告
实验日期:____年___月___日 实验者:_____ 学号:____
一、实验目的
二、实验原理(扼要叙述)
三、实验内容
1.0.02mol·L -1 EDTA溶液的配制
2.0.02mol·L -1 标准钙溶液的配制
3.0.02mol·L -1 EDTA溶液的标定
四、实验数据记录及处理
1.0.02mol·L -1 EDTA溶液的配制
EDTA的质量:_____g;EDTA溶液的体积:_____mL。
2.0.02mol·L -1 标准钙溶液的配制
CaCO 3 的质量:_____g;Ca 2+ 离子的浓度:_____mol·L -1 。
3.0.02mol·L -1 EDTA溶液浓度的标定
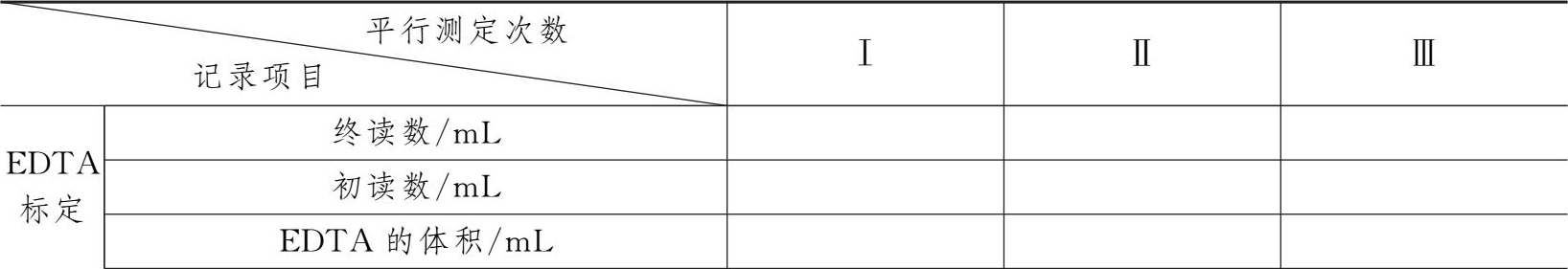
表1-2 0.02mol·L -1 EDTA溶液浓度的标定数据记录表
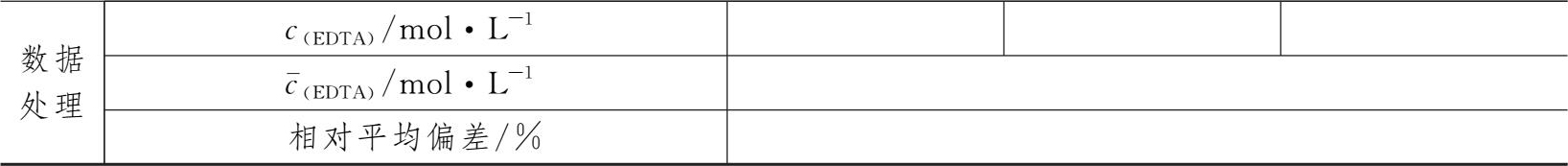
五、讨论
内容可以是实验中发现的问题、误差分析、经验教训总结,对指导教师或实验室的意见和建议等。
六、思考题