





营养性维生素D 缺乏性佝偻病(rickets of vitamin D deficiency)是由于儿童体内维生素D 不足,使钙、磷代谢紊乱,钙盐不能正常沉积在骨骼生长的部位,骨组织矿化不全,产生以骨骼病变为特征的一种全身慢性营养性疾病。
人体内维生素D 的来源分为内源性和外源性两种。
又称内源性维生素D,是人体维生素D 的主要来源。 皮肤中7-脱氢胆骨化醇(7-DHC),即维生素D 生物合成的前体,经日光中紫外线照射(290~320nm 波长),变为胆骨化醇,即内源性维生素D 3 。 每日户外活动1~2 小时即可满足机体维生素D 的需要。
又称外源性维生素D。 根据食物的来源分为动物和植物两种。 动物食品中的维生素D 主要是维生素D 3 ,海鱼和肝脏中含量丰富,乳类、蛋黄和肉类等含量少,谷类、蔬菜和水果中几乎不含。 植物食物中的维生素D 主要是D 2 ,在植物油和酵母中含量丰富。
是胎儿维生素D 的来源。 胎儿通过胎盘的主动转运从母体获得维生素D\[25-(OH)D 3 \]。 胎儿体内维生素D 的量与母体维生素D 的营养状况及胎龄有关。 出生时25-(OH)D 3 的储存可满足生后一段时间的生长需要。
皮肤合成的维生素D 3 直接进入血循环,食物中的维生素D 2 在小肠刷状缘经淋巴管吸收入血。 这两种形式的维生素D(D 2 及D 3 )进入循环后与血浆中维生素D 结合蛋白(DBP)相结合,随血流至肝脏、脂肪及肌肉等组织内储存,经两次羟化后才能发挥生物学效应。 当机体需要时,体内储存的维生素D 首先在肝细胞25-羟化酶作用下,变成25-羟胆骨化醇\[25-(OH)D 3 \]。 25-(OH)D 3 从肝脏释放入血与α-球蛋白结合,再随血流至肾脏,在肾脏近端小管上皮细胞内1α-羟化酶的作用下变成1,25-二羟胆骨化醇\[1,25-(OH) 2 D 3 \]。 25-(OH)D 3 和1,25-(OH) 2 D 3 均有生物活性,1,25-(OH) 2 D 3 的生物是25-(OH)D 3 的100~200 倍。 25-(OH)D 3 是血液循环中的主要存在形式,含量较多且稳定,在血浆中半衰期为2~3 周,常作为机体维生素D 营养状况的指标。 1,25-(OH) 2 D 3 进入血液循环后经维生素D(DBP)结合蛋白转运至各种靶器官而发挥作用。 由于1,25-(OH) 2 D 3 主要是通过作用靶器官(主要是肠、肾、骨)的受体发挥作用,目前将1,25-(OH) 2 D 3 作为一种类固醇激素看待。
维生素D 的代谢受血1,25-(OH) 2 D 3 、甲状旁腺素(PTH)、降钙素(CT)和血清钙及血清磷的浓度调节(图5-2)。
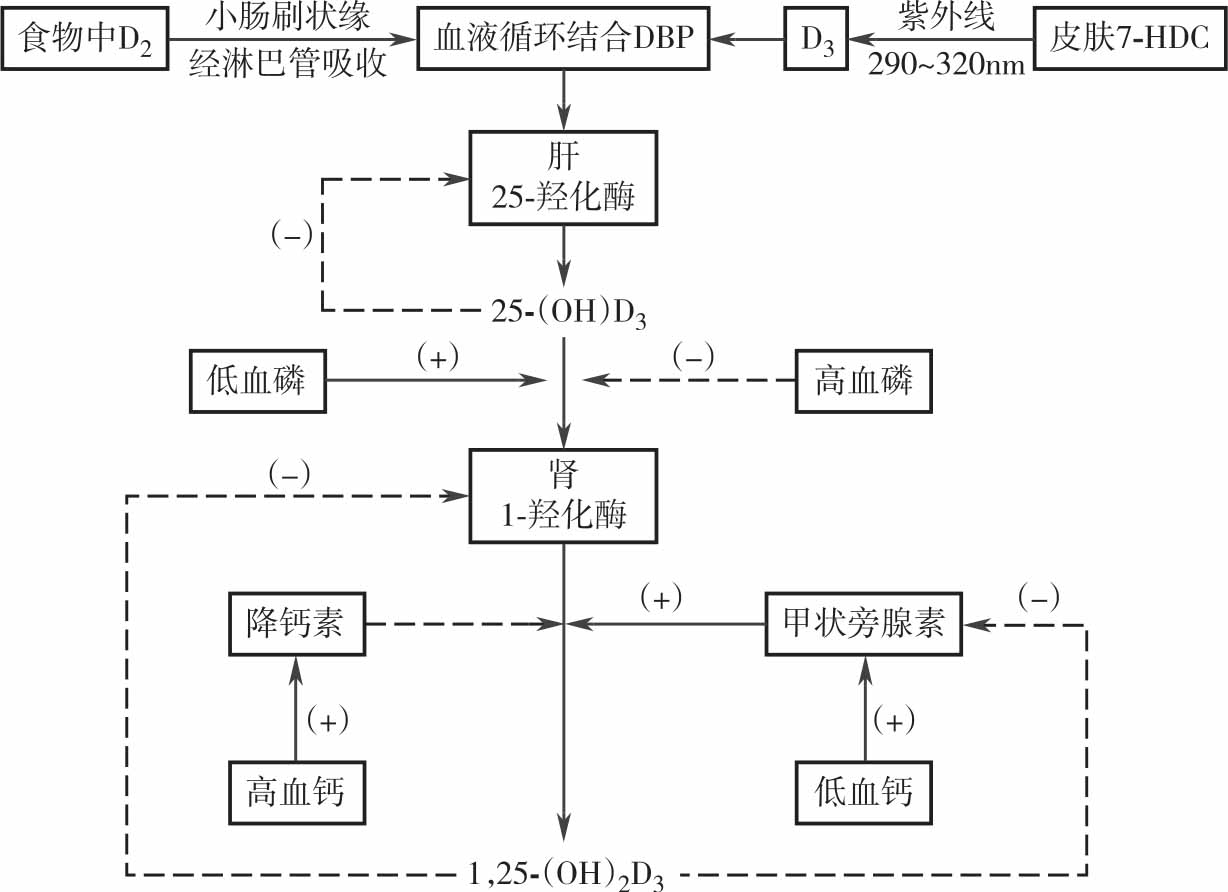
图5-2 维生素D 代谢的调节
正常情况下体内维生素D 合成与分泌受血中1,25-(OH) 2 D 3 的浓度自行调节。当体内产生足够量的1,25-(OH) 2 D 3 时,血中1,25-(OH) 2 D 3 浓度过高负反馈抑制维生素D 在肝脏及肾脏的羟化,达到自身调节的作用。
①血钙:血钙过低,甲状旁腺激素(PTH)分泌增加,直接刺激肾脏1,25-(OH) 2 D 3 的合成增加。 血钙过高,降钙素(CT)分泌增加,抑制肾小管羟化生成1,25-(OH) 2 D 3 。②血磷:低血磷直接促进1,25-(OH) 2 D 3 的合成增加,高血磷则抑制其合成。
生长激素、胰岛素和雌激素等也有促进1,25-(OH) 2 D 3 合成的作用。
正常情况下,1,25-(OH) 2 D 3 在血液循环中主要以结合形式存在,约85%与DBP 结合,15%与白蛋白结合,仅0.4%以游离形式存在而对靶器官发挥其生物效应。
1,25-(OH) 2 D 3 与PTH、降钙素相互作用,共同维持组织和体液钙、磷的稳定。
通过作用于肠、肾脏、骨等靶器官,发挥抗佝偻病的生理作用。 ①肠:促进小肠黏膜细胞合成钙结合蛋白(CaBP),促进钙、磷的肠道吸收。 ②肾脏:增加肾近曲小管对钙、磷的重吸收,特别是磷的重吸收,钙磷乘积升高,有利于骨的矿化作用。 ③骨:促进成骨细胞增殖和破骨细胞分化,直接影响钙、磷在骨的沉积与重吸收。 刺激成骨细胞,促进骨样组织成熟和钙盐沉积。 同时与甲状旁腺素协同使破骨细胞成熟,促进骨重吸收,使旧骨钙盐释放入血。
目前认为,1,25-(OH) 2 D 3 除上述作用外,还在造血系统、角化细胞及分泌甲状旁腺素和胰岛素的细胞、乳腺上皮等细胞分化与增殖中发挥多方面的重要作用。
孕后期由于摄入不足或疾病,如母亲营养不良、肝肾疾病、慢性腹泻导致维生素D 缺乏,早产、双胎均可使婴儿出生时体内维生素D 贮存不足。
皮肤经阳光紫外线照射合成内源性维生素D 是体内维生素D 的重要来源。 日照不足可影响内源性维生素D 的产生。
人乳和牛乳中维生素D 含量甚少,不能满足机体需要。 因此,纯母乳喂养者若不及时补充维生素D 或添加含维生素D 丰富的食物易发生维生素D 缺乏。
骨骼生长速度与维生素D 和钙需要量成正比。 婴幼儿生后生长发育快,需要维生素D 多,不及时补充易发生佝偻病。 青春期生长加速,如日光照射少、未及时补充维生素D,也可发生晚发性佝偻病。
肝胆及胃肠道慢性疾病,如婴儿肝炎综合征、先天性胆道狭窄或闭锁、脂肪泻、胰腺炎、慢性腹泻等会影响维生素D 的吸收利用;严重的肝肾疾病会影响维生素D 的羟化,1,25-(OH) 2 D 3 生成不足而引起佝偻病。
长期服用抗惊厥药物,苯妥英钠、苯巴比妥等,因刺激肝细胞微粒体氧化酶系统活性增加,维生素D 和25-(OH)D 3 分解为无活性的代谢产物加速,导致维生素D 的缺乏;糖皮质激素拮抗维生素D对钙的转运而导致佝偻病。
维生素D 缺乏或不足时,肠道吸收钙、磷减少,血钙水平降低,引起甲状旁腺功能代偿性亢进,PTH 分泌增加,使破骨细胞活性增加,成骨细胞活性降低,骨钙释放,使血清钙浓度维持在正常水平或接近正常水平。 维生素D 缺乏性佝偻病可以看成是机体为维持血钙水平而对骨骼造成的损害。 同时,维生素D 缺乏使肾小管对磷的重吸收减少,PTH 也可抑制肾小管对磷的重吸收,尿磷排出增多,血磷降低,钙磷乘积降低,骨样组织钙化障碍。 细胞外液钙、磷浓度不足使软骨细胞正常增殖、分化和凋亡的程序受损;钙化管排列紊乱,长骨钙化带消失,骺板失去正常的形态,参差不齐;骨基质不能正常矿化,成骨细胞代偿性增生,在干骺端造成骨样组织堆积,骺端增厚,向两侧膨出,形成“串珠”和“手足镯”等体征。 颅骨骨化障碍表现为颅骨变薄和软化,乒乓球感,颅骨骨样组织堆积出现“方颅”。 骨膜下骨样组织矿化不全,成骨异常,骨膜增厚,骨质疏松、软化,长骨负重后易发生骨骼弯曲,甚至病理性骨折。 此外,骨样组织堆积使碱性磷酸酶分泌增加,出现血生化改变(图5-3)。

图5-3 维生素D 缺乏性佝偻病和手足搐搦症的发病机制
本病多见婴幼儿,尤其是小婴儿,母孕期维生素D 缺乏者发病较早。 主要临床表现为生长最快部位的骨骼改变,肌肉松弛及神经兴奋性改变。 佝偻病的骨骼改变常在维生素D 缺乏数月后出现,并与年龄密切相关。 本病在临床上分为初期、活动期、恢复期及后遗症期4 期。
多见于6 个月以内,尤其3 个月以内的小婴儿。 此期骨骼改变不明显,主要表现为特异性症状,如神经兴奋性增高,如激惹、烦闹、睡眠不安、夜间啼哭、多汗(与气候无关)、枕秃(汗多刺激头皮而摇头擦枕)等。
实验室检查显示血清25-(OH)D 3 下降,PTH 升高,血钙浓度正常或稍低,血磷降低,碱性磷酸酶正常或稍高(表5-9)。 骨骼X 线可见正常或钙化带的稍模糊。
表5-9 维生素D 缺乏性佝偻病不同时期血生化改变

在神经精神症状的基础上,出现骨骼的改变和运动发育迟缓。 骨骼的改变发生在生长速度较快的部位,表现的部位与该年龄骨骼生长速度较快的部位相一致。
①颅骨软化:6 个月内小婴儿头部发育最快,是最早出现佝偻病体征的部位,检查者用指尖稍用力压颅骨可有明显的压乒乓球样的感觉,又称“乒乓头”。 ②骨膜下骨样组织增生:多见于7~8 个月以上的婴儿,额骨和顶骨双侧骨样组织逐渐增生堆积使颞骨、顶骨对称性隆起,从上往下看可见“方盒状”头颅即“方颅”,严重者出现“蝶鞍颅”或“十字颅”;③前囟大、闭合延迟:严重者可延迟至2~3 岁,头围也较正常增大;④乳牙萌出延迟:可迟至10 个月甚至1 岁以后出牙,有时可存在出牙顺序颠倒,或者牙釉质发育差,易患龋齿,严重时牙齿排列不齐、甚至可影响恒牙钙化。
改变多见于1 岁左右婴儿。 ①肋骨串珠(rachitic rosary):多发生在第7~10 肋,肋骨和肋软骨交界处骨样组织堆积膨大所致,外观似串珠,又称佝偻病串珠。 因膨大的肋软骨压迫肺组织,易患肺炎;②鸡胸及漏斗胸:肋骨骺部内陷致胸骨柄和邻近的软骨向前突出,形成“鸡胸”;如胸骨剑突部向内凹陷,则形成“漏斗胸”;③肋膈沟:由于肋骨软化,膈肌附着处的肋骨因受牵拉而内陷,在胸骨下缘形成一道水平的凹陷沟,又称郝氏沟(Harrison's groove),卧位更为明显。
①佝偻病手足镯:长骨干骺端骨样组织堆积增生肥大,引起手腕、足踝部形成环形、钝圆形隆起,形如手镯、脚镯。 多见于6 个月以上的婴儿。 ②下肢畸形:骨质软化与肌肉关节松弛,婴儿站立行走后因双下肢负重可出现股骨、胫骨及腓骨的弯曲变形,造成严重膝内翻(O 形)或膝外翻(X 形)畸形。 多见于1 岁左右能站立或行走的婴儿。 O 形腿检查及分度:小儿直立时,两腿靠拢测量两膝关节的距离:相距<3cm 为轻度,3~6cm 为中度,>6cm 为重度。 X 形腿的检查与分度,测量两腿靠拢时踝关节的距离,判断标准同O 形腿。 ③脊柱:患儿会坐与站立后,韧带松弛导致脊柱后凸或侧弯畸形,严重时可有骨盆畸形(髋外翻),导致生长迟缓、女性成年怀孕后难产。
低血磷所致肌肉中糖代谢异常,引起全身肌肉松弛,肌张力降低,导致坐、立、行等运动发育落后。 腹肌肌张力降低形成蛙腹。 严重维生素D 缺乏者可出现神经精神发育迟缓,免疫力低下,易合并感染及贫血。
实验室检测血25-(OH)D 3 明显下降,PTH 升高,血钙稍降低,血磷明显下降,钙磷乘积多小于30,碱性磷酸酶明显升高(见表5-9)。 X 线片提示长骨骨骺端增宽,钙化带消失,呈杯口状、毛刷状改变;骨骺软骨带增宽(>2mm),骨质疏松、骨皮质变薄,甚至骨干弯曲或青枝骨折,骨龄落后。
初期和激期患儿经治疗或日光照射后,神经精神症状消失,体征逐渐减轻或消失;血生化指标如25-(OH)D 3 、PTH、血钙、血磷恢复正常,碱性磷酸酶约1~2 个月后降至正常水平(见表5-9)。 治疗2~3 周后骨骼X 线改变有所改善,长骨干骺端由不规则逐渐变成增宽、致密增厚的钙化线,骨骺软骨带变薄(<2mm),骨质密度逐渐恢复正常。
多见于3 岁后的儿童,临床症状消失,血生化正常。 骨骼X 线干骺端病变消失。 婴幼儿期重症佝偻病患儿可残留不同程度的骨骼畸形或运动功能障碍。
又称胎儿性佝偻病,出生即出现佝偻病表现。 我国极北地区发病率高。 母孕期日光照射少、膳食中维生素D 不足导致胎儿体内维生素D 缺乏。 母孕期出现手足发麻,腰酸、腿肌痉挛等低钙的症状。 患儿出生时前囟门特大、前后囟门相通连,颅骨软化。 生后1 ~2 个月出现低钙抽搐,血清25-(OH)D 3 水平低,血钙、磷降低。 长骨X 线片显示钙化带消失、干骺端呈毛絮状改变。 此型应引起新生儿科医师高度重视。
根据维生素D 摄取不足的病史、临床症状和体征,结合血生化改变及骨骼X 线改变对维生素D 佝偻病进行诊断与分期。 血生化与骨骼X 线的检查在维生素D 缺乏性佝偻病的诊断中有重要价值,尤其是血25-(OH)D 3 含量是维生素D 缺乏性佝偻病早期诊断的金标准。 维生素D 营养状况以血清25-(OH)D 3 水平进行评价(表5-10)。
表5-10 维生素D 营养状况及25-(OH)D 3 水平(多数专家意见)

本病需与其他原因所致佝偻病、先天性甲状腺功能低下及软骨营养不良等疾病相鉴别。
①维生素D 依赖性佝偻病:常染色体隐性遗传,临床症状较重,血钙、磷显著降低,碱性磷酸酶明显升高,常继发甲状旁腺功能亢进。 临床上分两型:Ⅰ型为肾脏1-羟化酶缺陷,是1α-羟化酶基因突变所致,使25-(OH)D 3 转变为1,25-(OH) 2 D 3 过程发生障碍,血中25-(OH)D 3 浓度增高,多在1~2 岁后出现佝偻病表现,常伴有代谢性酸中毒和氨基酸尿症,需长期使用1,25-(OH) 2 D 3 治疗。 Ⅱ型为靶器官的1,25-(OH) 2 D 3 受体缺陷,是维生素D 受体基因突变,1,25-(OH) 2 D 3 不能发挥功能,血中1,25-(OH) 2 D 3 浓度明显升高,脱发是此型患儿的重要特征,50%~70%合并斑秃或全秃。 多在婴儿期发病,需大剂量1,25-(OH) 2 D 3 和钙治疗。
②继发性抗维生素D 佝偻病:各种原因所致的慢性肾功能障碍或肝功能损害所致,又称为肾性佝偻病或肝性佝偻病。 肾功能损害导致25-(OH)D 3 转变为1,25-(OH) 2 D 3 减少,引起血钙低、血磷高,甲状旁腺功能继发性亢进,骨质普遍脱钙,骨骼呈佝偻病改变。 佝偻病的症状体征多于幼儿后期逐渐明显,形成侏儒状态。 肝功能异常使25-(OH)D 3 生成障碍,若伴有胆道阻塞,可出现维生素D 和钙的吸收障碍。 临床特点为循环中25-(OH)D 3 明显降低,低血钙性抽搐和佝偻病体征。
③低血磷性抗维生素D 佝偻病:本病为性连锁遗传或常染色体显性或隐性遗传,为家族性低磷血症。性连锁遗传者的为Xp22.1-p22.2 基因突变,而常染色体显性遗传者为纤维生长因子23(FGF-23)基因突变,使肾小管磷重吸收及肠道磷吸收障碍,引起血磷降低,尿磷增加,血钙多正常。 多在1 岁以后出现佝偻病症状,2~3 岁后仍有活动性佝偻病表现,常有明显的下肢畸形。 维生素D 常规治疗剂量无效,需每日补充维生素D 3 0.05~0.25μg 或1,25-(OH) 2 D 3 0.5~1.5μg,并同时口服磷。
④远端肾小管性酸中毒:远曲小管泌氢不足,大量钠、钾、钙从尿中丢失,导致继发性甲状旁腺功能亢进,骨质脱钙,出现佝偻病的一系列症状及体征,有骨痛、骨折现象,骨骼畸形明显,身材矮小。 实验室检查发现代谢性酸中毒,除低血钙、低血磷之外,血钾亦低,并常有低血钾症状。 此外,患儿出现多尿、碱性尿(pH>6)。 维生素D 治疗无效。
①脑积水:生后数月出现头围逐渐进行增大,前囟大而饱满紧张,骨缝分离,甚至有“落日眼”。 无佝偻病四肢和胸部的体征,常伴有智力和运动发育落后。 头颅B 超、磁共振、CT 可确诊。
②先天性甲状腺功能低下:又称“呆小病”,出生2~3 月后开始出现甲状腺功能低下的表现,随着月龄的增大逐渐明显,出现典型的“呆小症”,检测血清T 3 ,T 4 ,TSH 可以确诊。
③软骨营养不良:是一种遗传性软骨发育障碍,出生时即可出现头大,前额突出,四肢及手指短粗,五指齐平,腰椎前凸、臀部后凸等,骨骼X 线可发现长骨粗短弯曲,干骺端变宽,呈喇叭口状,但轮廓光滑整齐,部分骨骼可埋入扩大的干骺端中的特征性改变。 临床根据短肢型矮小的特殊体态及骨骼X 线特征性改变而诊断。
④黏多糖病:是溶酶体贮积病中最常见的一种类型,为X 连锁隐性遗传或常染色体隐性遗传性疾病。因黏多糖代谢异常导致多器官受累,出现多发性骨发育不全,如头大、头型异常、脊柱畸形、胸廓扁平等体征。 主要依据骨骼的X 线变化,及尿中黏多糖的测定进行诊断。
控制病情活动,防止骨骼畸形和复发。 早发现、早治疗。
口服为主,目前不主张大剂量维生素D 治疗。
维生素D 1000~2000U(25~50μg)/d,口服1 个月后改400U(10μg)/d。
维生素D 3000~4000U(75~100μg)/d(中度)至5000~6000U(125~150μg)/d(重度)口服,有严重骨质疏松或自发性骨折严重病例者可适当增加剂量,但最大量不超过10 000U(250μg)/d,1 个月后改为400U(10μg)/d。
①根据病人具体情况决定维生素D 剂型、剂量大小、疗程长短、给药次数及途径的选择。 ②大量补充维生素D 时不要采用鱼肝油(维生素AD),因会导致维生素A 中毒。 ③对于各种原因不能口服者可采用1 次大剂量肌肉注射突击疗法,轻度用10 万~20 万U(2.5~3.75mg)/次,中重度用20 万~30 万U(5~7.5mg)/次。 肌肉注射前先口服10%葡萄糖酸钙或氯化钙3 天,以避免低钙抽搐的发生。 2 ~3 个月后改预防量400U(10μg)/d。 因大剂量突击疗法缺乏可靠的指标来评价血中维生素D 代谢产物浓度、维生素D 的毒性、高血钙症的发生以及远期后果,应严格掌握。 ④治疗1 个月后复查血生化指标及骨骼X 线,结合临床症状来判断是否有恢复征象。 如治疗后无改变或改变不明显应与其他疾病相鉴别。 ⑤治疗过程中应避免高钙血症、高钙尿症及维生素D 过量。
每天摄入牛奶大于500ml 者不需要额外补充钙剂。 对于有低钙血症表现、严重佝偻病及营养不良时需额外补充钙剂。
(1)坚持每日户外活动,适量的日光照射。
(2)加强营养,保证足够的奶量,及时添加转乳期食品。
(3)严重骨骼畸形采用主动或被动运动方法矫正,加强体格锻炼。 胸部畸形可作俯卧、抬头、展胸运动,下肢畸形可作肌肉按摩纠正畸形。 必要时考虑手术矫正。
营养性维生素D 缺乏性佝偻病是自限性疾病,一旦婴幼儿有足够时间户外活动,可以自愈。 本病的预防应从围生期开始,婴幼儿为重点预防的人群。 每日获得足够的阳光照射是预防的关键。
晒太阳是预防佝偻病最有效、方便、经济的方法。 充足的日光照射即可保证体内25-(OH)D 3 和1,25-(OH) 2 D 3 浓度正常。 因紫外线不能穿透玻璃,应强调户外运动,平均每天户外活动应大于1 小时,较合适的时间为上午9~10 点和下午3~4 点。
①新生儿从出生后数日开始补充维生素D 400U/d,并持续至儿童、青少年阶段。②母乳喂养婴儿,无论是否添加配方奶粉均需补充维生素D 400U/d。 ③妊娠期(妊娠后期)和哺乳期妇女需补充维生素D 400U/d 以上。 ④早产儿、低出生体重儿或双胎在新生儿期开始每日补充维生素D 800 ~1000U/d,3 个月后改预防量(400U/d)。
孕妇(尤其是妊娠晚期)的饮食中应含丰富的维生素D、钙、磷和蛋白质等营养物质,以防止胎儿宫内维生素D 储存不足。
维生素D 缺乏性手足搐搦症(tetany of vitamin D deficiency)是维生素D 缺乏所致血钙降低而引起的神经肌肉兴奋性增强的一种疾病,又称佝偻病性低钙惊厥或婴儿手足搐搦症。 主要表现为全身惊厥、手足肌肉抽搐或喉痉挛等症状,常见于2 岁内的婴幼儿,特别是6 个月以下的小婴儿。
维生素D 缺乏时,血钙降低刺激甲状旁腺,甲状旁腺素继发性分泌增多,使骨骼脱钙以补充血钙的不足;当甲状旁腺未出现代偿分泌增加时不能动员骨钙入血,血钙继续降低,当血清总钙量<1.75~1.88mmol/L(7~7.5mg/dl),或离子钙<1mmol/L(4mg/dl)时导致神经肌肉兴奋性增高,出现手足抽搐、喉痉挛、甚至全身惊厥等症状。 维生素D 缺乏时机体出现甲状旁腺功能低下的原因尚不清楚,可能原因是维生素D 缺乏的早期甲状旁腺急剧代偿分泌增加,以维持血钙正常;当维生素D 缺乏未能及时纠正,甲状旁腺功能因反应过度而出现代偿性功能不全,导致血钙降低。 维生素D 缺乏性手足搐搦症的患儿,同时存在佝偻病和甲状旁腺功能低下的低血钙临床表现(见图5-2)。
主要表现为惊厥、手足抽搐、喉痉挛等神经肌肉兴奋性增高的临床表现。 小婴儿主要表现为全身惊厥、喉痉挛,较大婴儿及幼儿多表现为手足搐搦。 由于维生素D 缺乏,患儿往往同时存在佝偻病的某些表现。
血清钙低于1.75mmol/L 时可出现惊厥、喉痉挛和手足搐搦,以无热惊厥最常见。
突然出现不伴发热的全身抽搐,是婴儿期最常见的发作方式。 表现为四肢抽动,两眼上翻,面肌颤动,神志不清,发作时间可短至数秒钟,或长达数分钟以上,发作时间长者可伴口周发绀。 发作停止后多入睡,醒后活泼如常。 可数日发作1 次,或1 日数次,甚至多至1 日数十次;一般不伴发热,发作轻时仅有短暂的眼球上窜和面肌抽动,神志清楚。
突发手足强直痉挛,表现为双手腕部屈曲,手指伸直、拇指内收掌心;足部踝关节伸直,足趾强直向下弯曲,足底呈弓状。 发作时意识清楚。
喉部肌肉及声门突发痉挛引起吸气性呼吸困难和喉鸣,有时可突然发生窒息、发绀,严重缺氧甚至死亡。 要特别注意小于6 个月的婴儿可表现为无热性阵发性青紫、严重者肌内注射时可能诱发喉痉挛。
血清钙在1.75~1.88mmol/L 时多无急性发作时的典型症状,但刺激神经肌肉可引出下列体征:
以手指尖或叩诊锤轻轻叩击患儿颧弓与口角间的面颊部(即第7 脑神经穿出处),引起眼睑和口角抽动者为阳性。 小于2 岁的患儿均可得到阳性结果,但1 个月内的婴儿可出现假阳性。
以叩诊锤骤击膝下外侧腓神经处可引起足向外侧收缩者即为腓反射阳性。
以血压计袖带包裹上臂,使血压维持在收缩压与舒张压之间,5 分钟之内该手出现痉挛状属阳性。
婴幼儿突发无热惊厥,发作后神志清楚,无神经系统阳性体征,且反复发作者;实验室检查总血钙<1.75mmol/L,或离子钙<1.0mmol/L;结合佝偻病病史及相应临床表现可诊断本病。 但应与下列疾病进行鉴别。
常发生于清晨空腹时,有进食不足或腹泻病史,严重惊厥后可昏迷。 一般口服或静脉注射葡萄糖液后抽搐立刻停止,实验室检查血糖<2.2mmol/L。
多见于新生儿或<3 个月牛乳喂养的小婴儿,常常合并低钙血症,可出现烦躁、惊跳、阵发性屏气,甚至惊厥。 实验室检查提示血清镁<0.58mmol/L(1.4mg/dl)。
1 岁内起病,突然发作,表现为头、躯干、上肢均屈曲,手握拳,下肢弯曲至腹部,伴点头状抽搦和意识障碍,发作时间维持在数秒至数10 秒,可自行停止;常伴有智力发育异常,脑电图有特征性的高幅异常节律波出现。
临床表现与本病较为相似,表现为间歇性惊厥或手足搐搦,几天或数周发作1 次;实验室检查提示血磷升高>3.2mmol/L,血钙降至1.75mmol/L 以下,碱性磷酸酶正常或稍低,颅骨X 线可见基底节钙化灶。
脑膜炎、脑炎、脑脓肿等,患儿大多数伴有发热和感染中毒症状,精神萎靡、一般情况差等。 体弱年幼者反应差,有时可无发热。 有颅内压增高体征及脑脊液改变。
多为病毒感染引起,常有上呼吸道感染的病史及症状,表现为声音嘶哑,伴有犬吠样咳嗽和吸气困难,可有发热,无低钙的症状及体征,血钙正常,钙剂治疗无效。
治疗原则是首先控制惊厥、解除喉痉挛,其次静脉补钙使血钙迅速上升,最后补充维生素D,使钙磷代谢恢复正常。
①地西泮:每次0.1~0.3mg/kg,肌内或静脉注射,必要时可10 分钟重复1 次,单剂最大量每次不超过10mg。 ②苯巴比妥钠:首剂15~20mg/kg 后改为每次2.5~5mg/kg,1~2 次/d,肌注或静脉注射。 ③10%水合氯醛每次40~50mg(0.4~0.5ml)/kg,保留灌肠,总量不超过10ml。 使用上述药物迅速控制惊厥或喉痉挛等危及生命的症状。
惊厥或喉痉挛可引起缺氧、呼吸停止,应立刻给氧。 喉痉挛者须立刻将舌头拉出口外,以保证呼吸道通畅,并行人工呼吸或复苏囊正压通气,必要时行气管插管术。
尽快给予10%葡萄糖酸钙1~2ml/kg 加入5%~10%葡萄糖液10~20ml 中,缓慢静脉注射或滴注(大于10 分钟),迅速提高血钙浓度。 惊厥停止后改为口服钙剂。 轻症患儿可用10%氯化钙5~10ml/次,每日3 次,服用时用加入3~5 倍糖水稀释,3~5 天后改为葡萄糖酸钙、乳酸钙或碳酸钙。
应用钙剂和症状控制后,同时给予维生素D 治疗,用法可按维生素D 缺乏性佝偻病补充维生素D。
同维生素D 缺乏性佝偻病。
维生素A 缺乏症(Vitamin A deficiency disorder)是指体内维生素A(视黄醇)缺乏所致的全身性疾病,可引起眼睛、生长、免疫和胚胎等多系统受损,多见于1~4 岁儿童。
维生素A 是指具有全反式视黄醇生物活性的一组类视黄醇物质,是所有β-紫香酮衍生物的总称,包括视黄醇、视黄醛、视黄酸及视黄酯等。 维生素A 原或类胡萝卜素是具有生物活性β-胡萝卜素的总称,主要存在绿色或黄红色蔬菜和水果中,其化学结构与维生素A 相似,在体内可转化为维生素A,以β-胡萝卜素具有的维生素A 活性最高。 维生素A 和胡萝卜素在小肠中被乳化后由肠黏膜吸收,并在肠黏膜细胞内经棕榈酸酯化后与乳糜微粒结合,通过淋巴系统入血行然后转运到肝脏,以棕榈酸酯形式在肝脏储存。 肝内维生素A 储存量占总量的90%~95%。
当周围组织需要维生素A 时,肝脏中的维生素A 棕榈酸酯经酯酶水解为视黄醇,与视黄醇结合蛋白(retinal binding protein,RBP)结合后,再与前白蛋白(prealbumin,PA)结合,形成维生素A-RBP-PA 复合体后释放入血,经血液循环转运至靶组织。 该复合物与靶组织细胞膜上的RBP 特殊受体结合后,维生素A 被释放至细胞内,并进一步在细胞内氧化转变为视黄酸。 视黄酸是维生素A 在体内发生多种生物作用的重要活性形式。
维生素A 在维持人体正常代谢、细胞分化、生殖、视觉及抗感染等多种生理功能中发挥重要的作用,当缺乏后会导致多种生理功能紊乱,从而产生一系列病理变化。
维生素A 缺乏时,对暗光的敏感度降低,出现暗适应差及夜盲症。
维生素A 为细胞分化、视黄酸应答激活及细胞膜稳定所必需,缺乏时导致皮肤、眼结膜和角膜干燥,继续缺乏使上皮组织过度增生。
维生素A 通过参与细胞的RNA、DNA 合成及生长激素的分泌,影响细胞增殖、分化和组织更新;促进硫酸软骨素等粘多糖合成和骨代谢,从而促进生长发育。 维生素A 对胎盘发育、精子生成多种组织和细胞生长发育起有重要作用,缺乏可引起心、脑、肺和泌尿生殖系统等先天畸形。
维生素A 缺乏时,免疫细胞内视黄酸受体的表达相应下降而导致机体的免疫功能降低,患儿易患呼吸道和消化道感染。
维生素A 和胡萝卜素不易通过胎盘,出生时体内维生素A 储存量甚少,肝脏维生素A 仅为成人的1/10,同时新生儿血浆中视黄醇结合蛋白仅为成人一半。 生后如不注意补充,极易出现维生素A 缺乏。 5 岁以下儿童维生素A 缺乏的发生率远高于成人。
维生素A 主要来源于乳类、蛋黄、肝脏和深色蔬菜,母乳初乳中维生素A 含量丰富。 婴儿母乳不足或无母乳、未及时添加配方奶或牛奶,长期给予单纯米粉或脱脂奶粉喂养,或长期摄入缺乏维生素A 和胡萝卜素的膳食者,导致维生素A 缺乏。 早产儿、双胎儿低出生体重儿等,生后生长发育迅速,更易发生维生素A 缺乏。 各种急慢性传染病,如麻疹、结核病等长期发热性疾病使维生素A 消耗增多,机体对维生素A 需求增多,会导致相对缺乏。
维生素A 为脂溶性维生素,它和胡萝卜素在小肠的消化吸收均需胆盐和脂肪的帮助。 因此,膳食中脂肪的含量过低、慢性肠道疾病、肝胆胰疾病、脂肪吸收综合征等都可以影响维生素A 的消化与吸收,导致维生素A 缺乏。
凡能导致蛋白质和锌缺乏的各种因素都可影响维生素A 的转运和利用。 肝脏疾病、甲状腺功能低下及先天性维生素A 原转换酶缺乏等使维生素A 原转变成维生素A 发生障碍及维生素A 转运障碍,导致血浆维生素A 降低。
维生素A 缺乏症的临床表现与维生素A 缺乏的程度和阶段关系密切,在亚临床缺乏及可疑亚临床缺乏阶段主要为反复呼吸道感染、腹泻和贫血等非特异性表现。 在重度缺乏阶段,血清维生素A<0.35μmol/L 时,才会出现维生素A 缺乏的特异性临床表现。
眼部的症状和体征是维生素A 缺乏最早出现的表现,且逐渐加重。
是维生素A 缺乏时最早的表现,首先表现为暗适应迟缓,暗适应时间延长,随后黄昏时视物不清,暗光视力下降,最终发展为夜盲症。
暗视觉异常持续数周后,出现眼泪减少,眼干、眨眼、畏光等不适,俗称“干眼病”。 随后出现球结膜、角膜干燥,失去正常光泽和弹性,自觉痒感,眼部检查眼球向两侧转动时可见球结膜皱褶,在近角膜处可见结膜干燥斑或毕脱斑(Bitot's spots)。
即角膜软化症。 自觉畏光、眼痛,常用手揉搓眼部导致感染。 严重时发生角膜溃疡、坏死甚至穿孔,虹膜、晶状体脱出,导致失明,是年幼儿童失明的重要原因。
开始仅感皮肤干燥、易脱屑,有痒感,渐至汗液减少、上皮角化增生,角化物充塞毛囊形成突出皮肤表面的毛囊丘疹,状似“鸡皮”。 检查触摸皮肤时有粗砂样感,以肩部、臀部、四肢伸面为多,可发展至颈部、背部甚至面部,会阴上皮也可角化。 毛囊角化引起毛发干枯、易脱落,指(趾)甲脆薄易折、多纹等。
表现为体格和智力轻度落后,常伴营养不良、贫血和其他维生素缺乏。 牙釉质发育不良、易剥落,失去光泽,易发生龋齿。
易出现反复的呼吸道和消化道感染,且迁延不愈,增加疾病的发病率和死亡率,尤其见于是6 个月~2 岁的儿童。
根据明确维生素A 摄入不足病史、有各种消化道和呼吸道疾病或慢性消耗性疾病史,出现夜盲症或干眼症等眼部特异性表现及皮肤的症状和体征,即可临床诊断。 下列实验室和临床检查有助于可疑病例及亚临床维生素A 缺乏的早期诊断。
为评价维生素A 营养状况常用指标。 正常婴幼儿血浆维生素A 浓度为300~500μg/L(1.05 ~1.76μmol/L),年长儿和成人为430 ~860μg/L(1.5 ~3.0μmol/L)。 <200μg/L(0.7μmol/L)为临床型和亚临床型维生素A 缺乏,200 ~300μg/L(0.7 ~1.05μmol/L)为可疑亚临床维生素A 缺乏。 临床型维生素A 缺乏:血清维生素A<0.35μmol/L,伴有眼部和皮肤临床表现。 亚临床型维生素A 缺乏:血清维生素A 0.35~0.7μmol/L,无典型的临床表现。
对可疑亚临床维生素A 缺乏者应行RDR 进一步确定。测定方法为先空腹抽静脉血测定血浆维生素A 浓度(A 0 ),然后随早餐口服维生素A 450μg,5 小时后于午餐前再次采集静脉血复查血浆维生素A(A 5 ),将数值代入公式:RDR(%)=(A 5 -A 0 )/A 5 ×100%,所得RDR值可提示肝维生素A 储备。 RDR>20%则为阳性,表示肝脏维生素A 储备<70μmol(20mg)/kg,可确诊为亚临床型维生素A 缺乏。
正常血浆浓度为23.1mg/L,低于此值提示有维生素A 缺乏的可能,感染、蛋白质-能量营养不良RBP 亦可降低,应同时查血C-反应蛋白(CRP)。
有助于维生素A 缺乏诊断,找到角化上皮细胞具有诊断意义。 在新鲜中段尿中加1%甲基紫,摇匀后计数尿中上皮细胞,在没有泌尿道感染的情况下,超过3 个/mm 2 为异常。
由眼科医师用暗适应计和视网膜电流变化检查,常用于亚临床维生素A 缺乏诊断,该方法不适用于婴幼儿,且蛋白质和锌缺乏时暗适应时间也会延长。
主要是调整饮食和去除病因,增加膳食中维生素A 及β-胡萝卜素的摄入,有条件者可给予维生素A 强化的食品。 积极治疗原有慢性疾病,如营养不良、迁延性腹泻、肝胆疾病及营养素缺乏病等,以增强对维生素A 及β-胡萝卜素的吸收。
口服维生素A 1500~2000U/d,直到血浆维生素A 水平正常。 或大剂量口服10 万~20 万U/次,每4~6 个月重复1 次。
①轻症及消化吸收功能良好者:口服维生素A 7500 ~15 000μg/d(相当于2.5 万~5 万U/d,浓维生素A 丸含2.5 万U/丸),分为2~3 次服用,2 天后减量为每天口服1500μg(相当于5000U)/d。 ②有慢性腹泻或肠道吸收障碍及重症患(眼症)者:深部肌注维生素AD 注射剂(每支含维生素A 7500μg 和维生素D 62.5μg)0.5~1ml/次,每日1 次,5 天后病情好转即改口服,到眼部症状消失后改预防量1500μg/kg,直到痊愈。 或采用大剂量补充法:诊断后立即治疗:6 个月:5 万U;6 ~12 个月:10 万U;>12 个月:20 万U。 第二天使用同样剂量1 次,2 周后再用同样剂量1 次;确诊麻疹的患儿立即给予单剂量1 次,第二天再给予相同剂量1 次;蛋白质营养不良患儿确诊时给予单剂量,此后按维持需要量补充。 治疗中要注意避免维生素A 过量所致中毒(1 视黄醇当量=1μg 视黄醇=3.3U 维生素A)。
对比较严重的维生素A 缺乏病患儿需要进行眼睛局部治疗。 进行眼部治疗和护理时动作轻柔,不要压迫眼球,以免角膜穿孔,虹膜、晶状体脱出。
(1)消毒的维生素AD 滴剂直接滴眼。
(2)抗生素眼药:2.5%氯霉素眼药水或0.5%金霉素或红霉素眼膏,每日3 ~4 次,以预防结膜和角膜发生继发感染,并可减轻结膜与角膜的干燥不适。 如角膜出现软化和溃疡时,可采用抗生素眼药水与消毒鱼肝油交替滴眼,1 小时1 次,每日不少于20 次。
(3)1%阿托品滴眼液:用于角膜溃疡时散瞳,以免虹膜脱出及粘连。
(4)上皮生长因子类眼液:有助于角膜修复,每天3 次。
经常食用富含维生素A 的动物性食物(牛奶、鸡蛋、肝脏)和深色蔬菜及黄红色水果。
婴幼儿是预防维生素A 缺乏的主要对象,孕妇和乳母应多食富含维生素A 的食物,以保证新生儿和乳儿有充足的维生素A 摄入。
人工喂养婴儿应尽量选择维生素A 强化的乳方。
每日推荐供应量:婴幼儿为500μg,5 岁以上儿童为600 ~1500μg,维生素A缺乏地区产妇分娩后30 000μg。
采取每隔半年一次口服维生素A 的预防措施:<6 个月17 000μg/次;6~12 个月33 000μg/次;>12 个月66 000μg/次。
麻疹、疟疾和结核病等,及慢性消耗性疾病的病人应补充维生素A 1500 ~3000μg/d。 有慢性腹泻等维生素A 吸收不良者可短期内肌内注射维生素A,数日后再改为口服,或采用水溶性维生素A 制剂。