





液体分子逸出液面进入空间的现象叫做蒸发。若蒸发是在密闭的真空容器中进行,则逸出的蒸气分子又能返回液体中去,当气-液两相达到平衡时,蒸气具有的压力称为饱和蒸气压。饱和蒸气压的大小与温度有关(如图2-4)。从图中可知,加热液体,它的蒸气压随温度升高而增大。在开口容器中,当蒸气压增大到与施于液面的外压力相等时,气-液两相共存达到平衡,气化不仅在液面发生,在液体内部也有大量气泡逸出,即液体沸腾。此时的温度称为该压力下的沸点。图2-4不仅说明温度对饱和蒸气压的影响,同时也表明外压力对沸腾温度的作用。外压低时,沸腾时所需的蒸气压也下降,于是液体便在较低的温度下沸腾;相反则沸腾温度要升高。当外压为一个大气压(760毫米汞柱)时,此时的沸点称为标准沸点,即正常沸点。在一定的大气压力下,各种纯的液体有机化合物具有一定的沸点,在实验测定时,温度变动的范围(沸程)很小,在0.5℃~1℃左右。有杂质的液体化合物沸点范围就较大,一般超过5℃。所以测定沸点也是鉴定有机物及其纯度的一种方法。但应指出的是,具有固定沸点的液体不一定都是纯化合物,如95%乙醇和水组成的二元共沸混合物,它们也有一定的沸点。
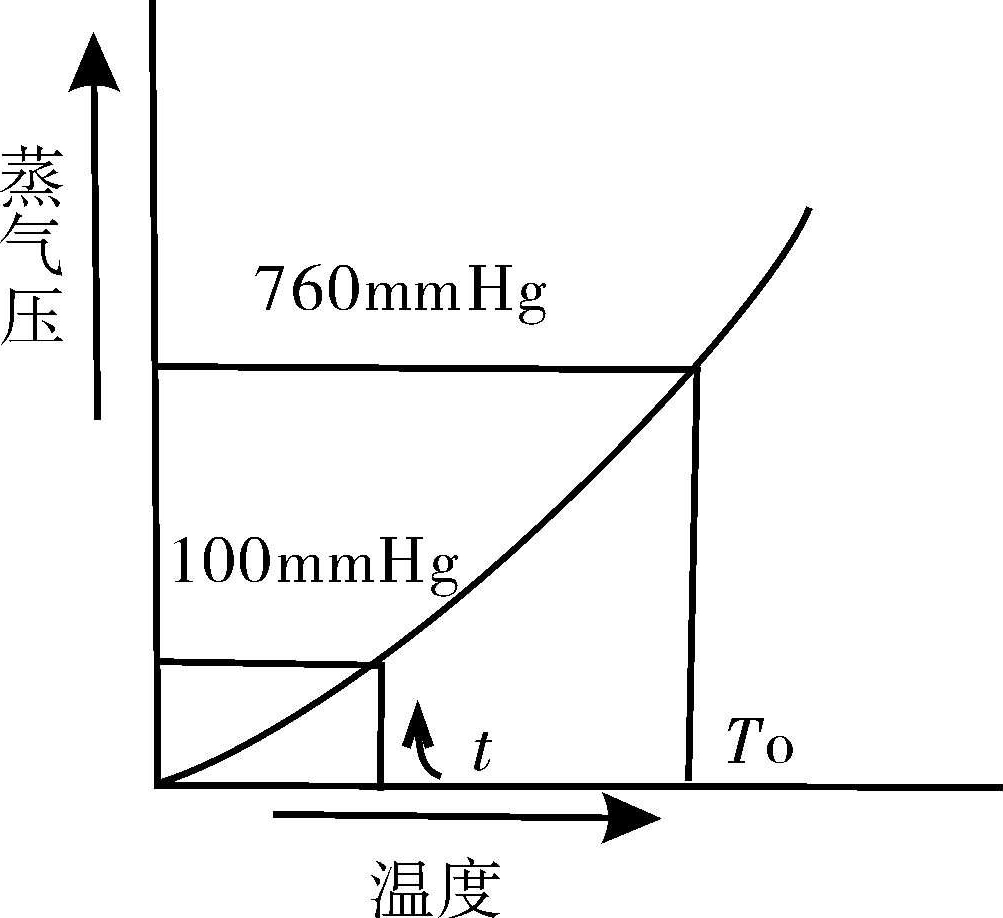
图2-4 蒸气压的大小与温度的关系
由于沸点对于外界压力很敏感,所以在测定沸点时均应记录压力,例如“bp 25℃(750毫米汞柱)”。若是任意压力下测得的沸点,可按下列公式换算成标准状态时的沸点:
T 0 =t-(0.030+0.000 11t)ΔP。
T 0 ——标准状态时的沸点。
t——测得的沸点。
ΔP——测定沸点时的大气压与标准大气压之差。
沸点的测定,常使用常量法和微量法。用蒸馏法来测定沸点叫常量法,此法样品用量较大,要10mL以上。若样品不多时,可采用微量法,这里介绍微量法测定沸点。
(1)取一根直径约4毫米,长8厘米的小玻管做外管,另一根直径约1毫米,长8厘米,一端封闭的毛细管做内管,内管倒插(开口向下)入外管中,组成沸点管,依次注入1~2滴样品液(无水乙醇、苯或未知样)后,将沸点管用橡皮圈固定在温度计上,并使液体部分与温度计水银球对齐,如图2-5所示。温度计通过开口软木(胶)塞塞在提勒管上,温度计的水银球不能触及管壁或管底,要放在提勒管上下两支管口之间,用导热液作传热介质,加热,小玻管的管口要高出热浴液面3~4毫米(如图2-5)。
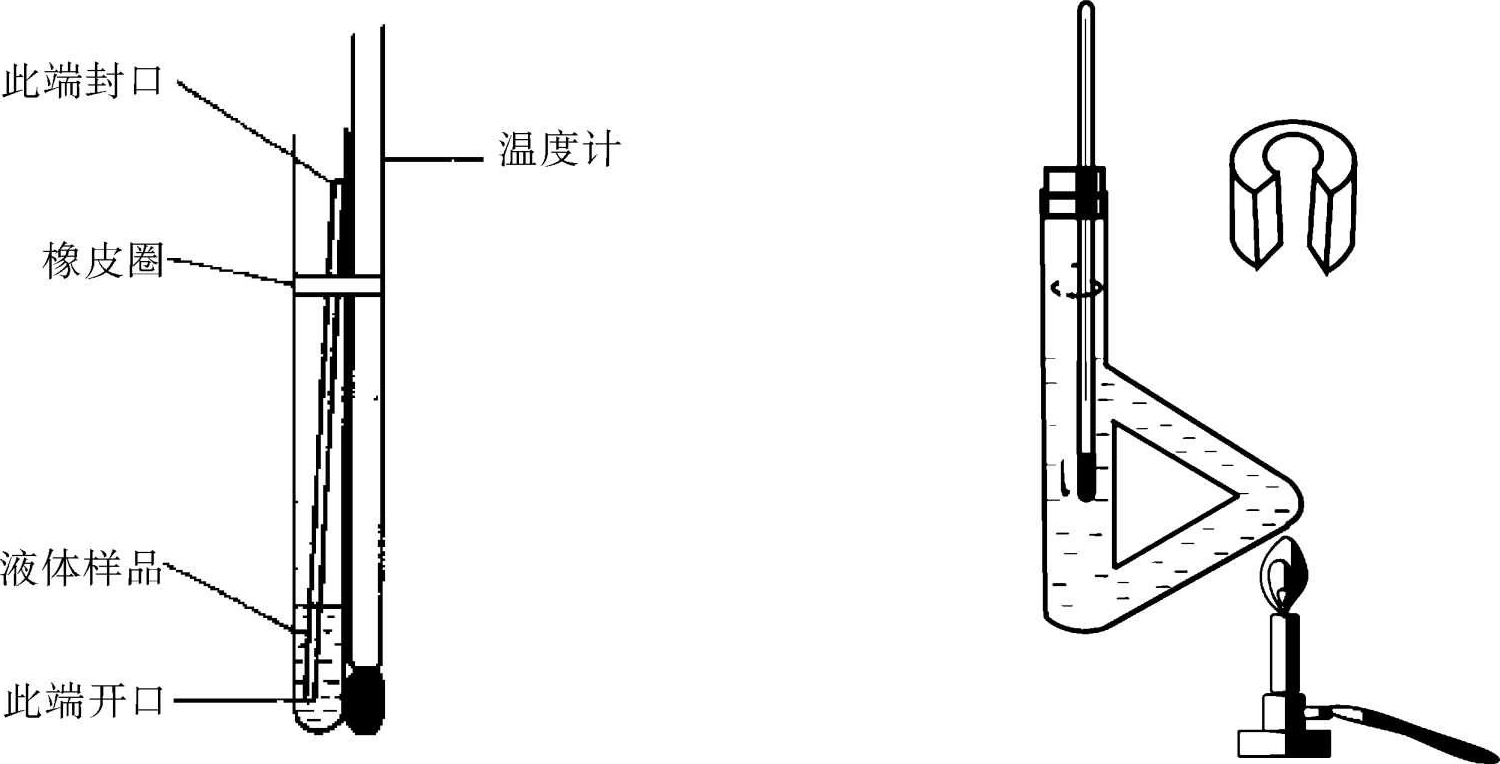
图2-5 微量法测定沸点装置
(2)加热提勒管,当毛细管内冒出一连串快而连续不断的气泡时,表明内管的蒸气压大于大气压,可停止加热。让浴温自行下降,气泡逸出的速度减慢,等到气泡不再冒出而液体刚要进入毛细管(即最后一个气泡开始回入内管时)的瞬间,这时毛细管内液体表面的蒸气压和外界大气压相等,记录此时的温度,即为该试样的沸点。一个样品平行测三次,每次数值相差不应超过1℃。