




 原子分辨率的双螺旋
原子分辨率的双螺旋
罗森堡等
编者按
直到现在,由弗朗西斯·克里克和詹姆斯·沃森提出的DNA双螺旋结构仍无可置疑。尽管如此,利用X射线晶体学的方法获得高分辨率结构以便直接观察原子位置的研究还没有人进行过。莱纳斯·鲍林的博士后亚历山大·里奇以及他的同事在本文中报道了一小段RNA(而不是DNA)的双螺旋结构。此项工作使人们第一次直接观察到沃森–克里克碱基配对,并且对其结构的正确性进行了精彩的证实。里奇的一位合作者纳德里安·西曼继而开创性地将DNA作为构建材料应用到了分子纳米技术中。 英文
二核苷磷酸腺苷–3′,5′–尿苷磷酸的钠盐以右手反向平行双螺旋的形式结晶,尿嘧啶和腺嘌呤之间形成沃森–克里克氢键。一个钠离子位于双螺旋的小沟,与两侧的两个尿嘧啶环结合。 英文
分子生物学中的许多重要功能皆由两条链之间形成碱基互补配对的反向平行双螺旋核酸决定,沃森和克里克首次对其进行了描述 [1] 。尽管人们对双螺旋核酸的结构已经开展过大量的研究 [2-8] ,却还从未获得过精细的原子分辨率的分子结构。由DNA和RNA纤维获得的X射线衍射图样的分辨率无法超过3 Å。基于这一现实,人们对双螺旋DNA中精细的立体化学结构及氢键形成的真实本质开展了诸多讨论 [9-13] 。将已知序列的寡聚核苷酸片段进行结晶是获得更多DNA的原子结构细节的一种途径,它们可能在晶格中形成双螺旋结构。本文报道了由腺苷–3′,5′–尿苷磷酸(ApU)的钠盐所形成的右手反向平行双螺旋的单晶体X射线分析结果,其中的核糖磷酸骨架通过在腺嘌呤和尿嘧啶残基之间形成沃森–克里克氢键而结合在一起。这是第一个可以看到双螺旋核酸原子细节的晶体结构。此外,这也是第一个显示腺嘌呤和尿嘧啶之间的确能形成沃森–克里克碱基配对的单晶体结构。 英文
在40%的2–甲基–2,4–戊二醇(MPD)溶液中,将ApU(迈尔斯公司生产)的钠盐与三溴丁胺按化学反应计量比混合。在一个密闭容器中,将少量该混合物溶液置于含60% MPD的大体积溶液中在4℃进行平衡。静置两周后,开始出现具有清晰表面的细小棱状晶体。晶体持续缓慢生长数月,最终形成适用于X射线分析的晶体。之所以在溶液中加入胺,是希望其成为结构中的阳离子;不过,之后的分析表明,形成晶体的是钠盐而非溴胺。一个大小为0.2 mm×0.15 mm×0.05 mm的晶体置于一玻璃纤维的尖端进行X射线分析。分析显示,晶体为单斜晶系,空间群为P2 1 ,晶胞大小为: a =18.025 Å, b =17.501 Å, c =9.677 Å, β =99.45º。在密度梯度中测得晶体密度为1.53。为了使计算出的密度值接近观测到的密度,我们必须假设在一个晶胞中含有4个分子的Na + ApU – 和22个分子的水。这种令人惊讶的高度水合现象被后来的结果证明仍然是被低估的,因为结构分析结果表明,一个晶胞含有24个分子的水。利用“皮克”式FACS-1衍射仪、采取“欧米茄”逐步扫描模式、以镍过滤的CuKα做光源,我们采集到了分辨率达到0.8 Å的三维X射线衍射强度数据。数据是在8℃采集的并校正了洛伦兹和偏振效应;由于质量吸收系数比较低(18.0),所以没有进行吸收校正。 英文
尽管晶格中没有晶体学二次轴,在帕特森函数的哈克截面上出现了约为初始高度40%的峰值,这提示在该结构中存在非晶体学二次轴。由此我们推断出了ApU的双螺旋本质。我们认为这一峰值包含了一个ApU分子中的每一原子到另一独立分子中相应原子的所有矢量,而且这些矢量是相关对称的。根据以前针对质子化尿苷–3′,5′–腺苷磷酸 [14] (UpA)这种二核苷磷酸的研究,人们已经知道,在辨别一个大的结构中源自两个第二排(编者注:应指元素周期表第三周期)原子的矢量时,分辨率差异帕特森技术是有效的。(分辨率差异帕特森技术是指将两种帕特森或叠加函数(如多个最小值函数或N原子对称最小函数)进行比较。这两种帕特森函数是:(1)标准 F 2 帕特森函数,采用全部衍射数据计算所得;(2)仅利用较高次序的反射数据计算出的帕特森函数,其 F s会包含更多所收集到的较重原子的权重,因为它们的原子中心附近相对更加致密。两种帕特森函数的初始值被归一化为相同的值。在第二张图上,源自重原子–重原子矢量的峰值应当比重叠的轻原子–轻原子向量相对更加明显。在本研究中,第一个帕特森函数包含了所有分辨率为1 Å的数据,而第二个函数包含了1.5 Å到1 Å之间的数据) 英文
UpA这种二核苷磷酸含有77个第一排(编者注:应指元素周期表第二周期)原子。因此,我们希望使用这一矢量作为“分辨率差异2–原子对称最小函数” [15,16] (RDSMF(2))的基矢量来定位磷原子。然而,RDSMF(2)最初对磷原子的定位是错误的。当傅里叶优化程序无法揭示该结构时,这一点就变得显而易见了。因此我们计算了一种( E 2 –1)帕特森函数( E 是准归一化的结构因子),并根据卡勒和豪普特曼 [17] 提出的流程,将其图谱和傅里叶系数校正为非负值和最小键长:(1)帕特森图谱上的所有负点及距原点0.9 Å半径以内所有的点都被归零;(2)对该图谱进行傅里叶变换,产生的所有( E 2 –1)系数小于–1的都被提到–1;(3)根据这些系数计算出一个新的帕特森图谱,重复该过程,直到第40轮得到收敛解为止。从最后的振幅中,产生了一组热锐化的 F s,并用于计算帕特森函数。从这些帕特森函数中计算得到的RDSMF(2)揭示了正确的磷原子位置。磷原子的大致取向是通过帕特森叠加得到的。使用校正过的 E s作为傅里叶振幅,进行14次傅里叶优化后,两分子ApU、钠离子和4个水分子的位置得以确定。其他水分子是通过一系列的差值合成而被定位的。使用各向同性热参数和仅1 Å的观察数据,通过全矩阵最小二乘法,我们对该结构进行了优化。目前得到的 R 因子为0.091。(偏离因子 R 被定义为: R =∑│| F o | – | F c |│/∑| F o |,其中| F o |和| F c |分别是观测到的和计算得到的结构因子的振幅。)因为这是没有用同晶置换解析的、较大的非中心对称生物晶体结构之一,我们将在以后发表的文章中交代解析方法的细节。 英文
经过分析,我们发现该结构有两个显著的特征。上文提到的非晶体学伪二次轴使一个ApU分子旋转到另一个ApU上方,因而该结构形成了一个右手反向平行双螺旋片段,其中的碱基以沃森–克里克方式相互形成氢键,如图1和2所示。这种存在于腺嘌呤和尿嘧啶之间的氢键为人们所熟知,它被认为相当普遍地出现在双螺旋的核酸分子中。尽管如此,这种氢键之前从未在单晶体的X射线分析中被观察到。应当注意的是,我们所说的二重轴位于两个碱基平面的中间线上,而非位于每一个碱基平面之中。位于碱基平面内的那个轴在文献中经常被讨论到,但是双螺旋的周期性本质使得在这两个位置上都能产生出对称元素。 英文
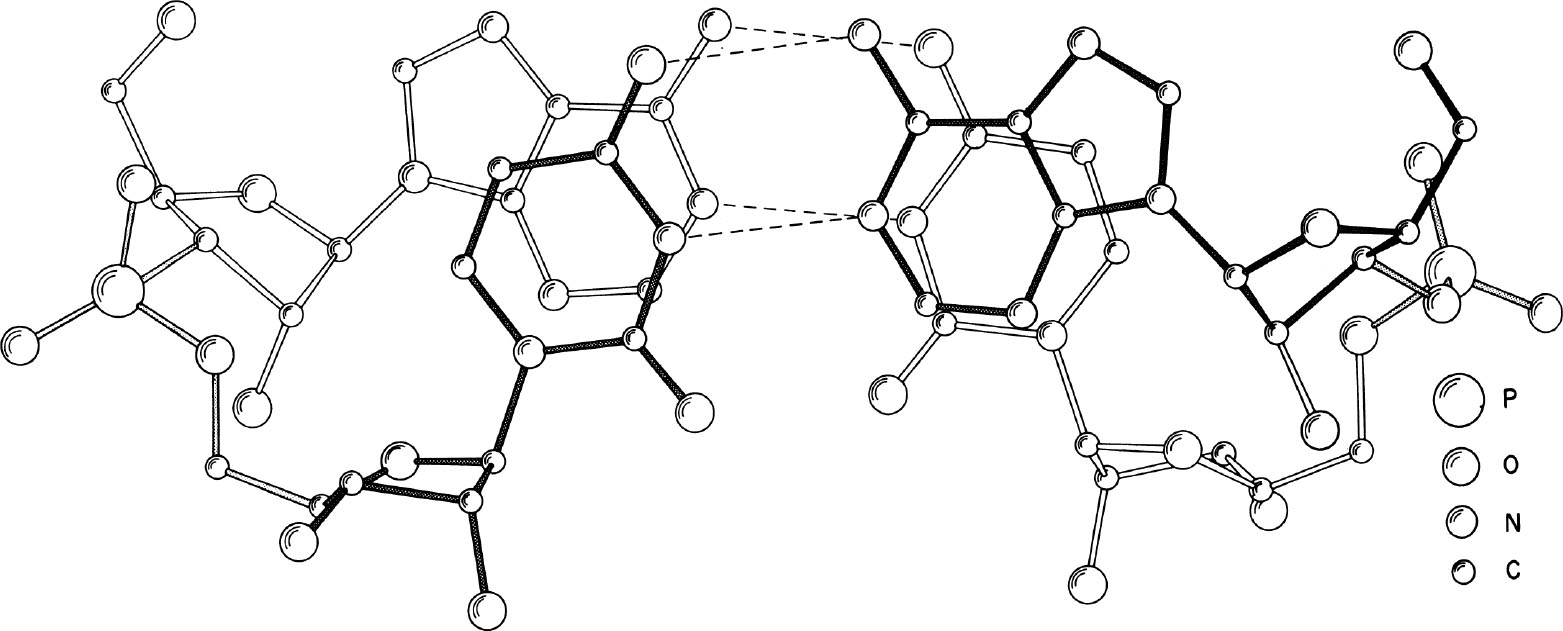
图1. 从垂直于碱基平面的方向观察晶体结构可以显示氢键(虚线)以及碱基堆积相互作用。图中颜色最深的部分距离观察者最近。通过比较前面的(黑色)和后面的(白色)糖苷键,可以很容易看出碱基之间的旋转关系。
另一个显著的特征是该晶体被高度水合,使得ApU分子被大量水分子包围。这一结果结合非晶体学二次轴的性质使我们相信,ApU的双螺旋本质源于分子本身的作用,而非晶体学堆积所致。 英文
碱基对之间的距离是3.4 Å,如图1所示,该结构中有相当程度的堆积。在腺嘌呤的N6氨基与尿嘧啶的O4羰基氧(碱基上各个原子的编号规则见图3)之间的NH…O氢键的键长分别为2.95 Å和2.91 Å。尿嘧啶N3和腺嘌呤N1之间的NH…N氢键长分别为2.82 Å和2.86 Å。另外一对重要的距离是横跨碱基对、参与糖苷键形成的两个核糖碳原子C1′之间的,分别是10.50 Å和10.53 Å。(译者注:这里的两个距离应该是指图3中的上面那对碱基之间的和下面那对碱基之间的相关原子之间距离)人们曾经通过分析嘌呤和嘧啶衍生物的分子间复合物的单晶体,得到过类似的距离 [18] ;但在形成了双螺旋片段的分子中测得这些距离,还是第一次。 英文
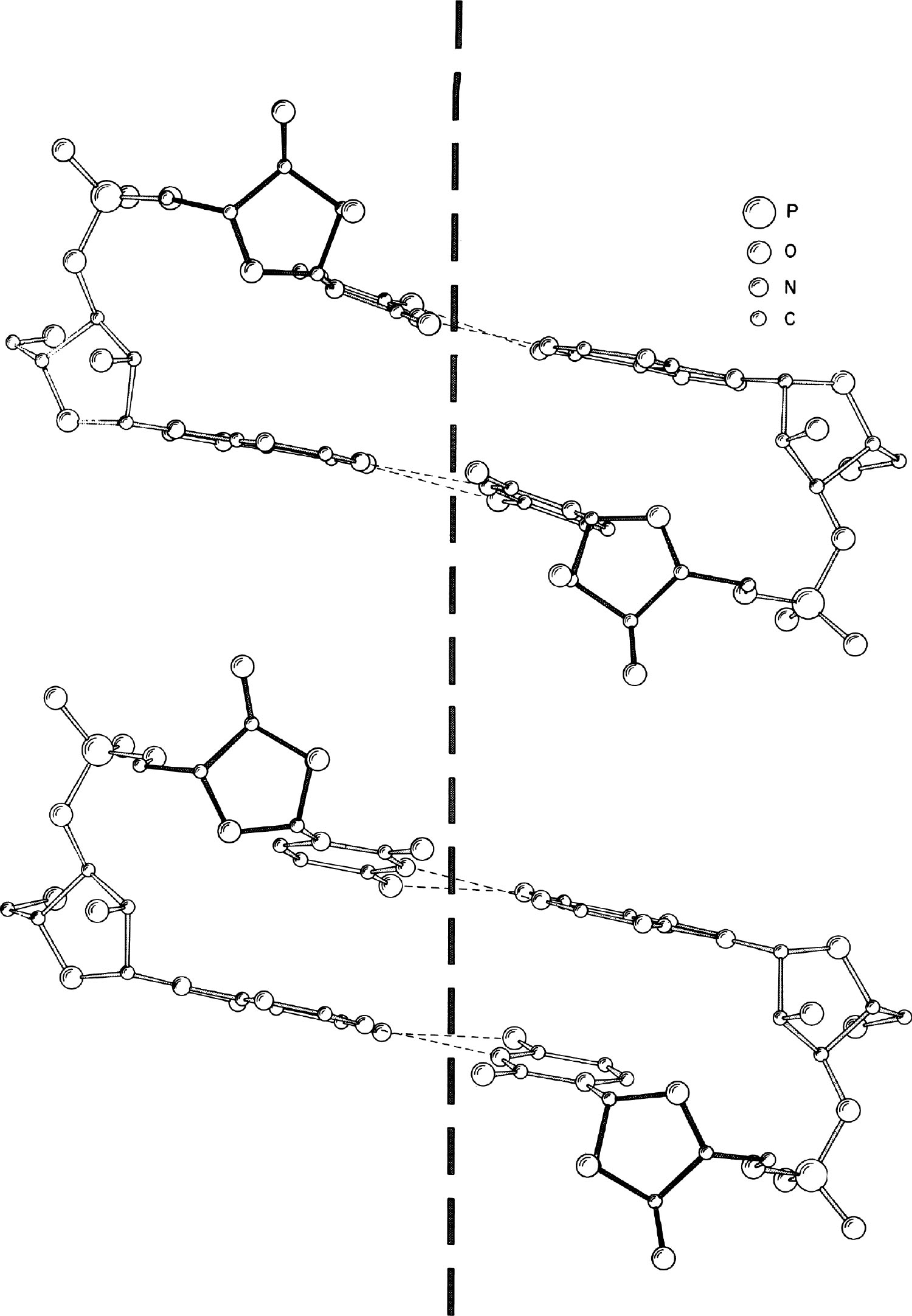
图2. ApU(上方)和RNA 11(下方)的结构比较。观察角度大致垂直于竖直虚线所示的螺旋轴。
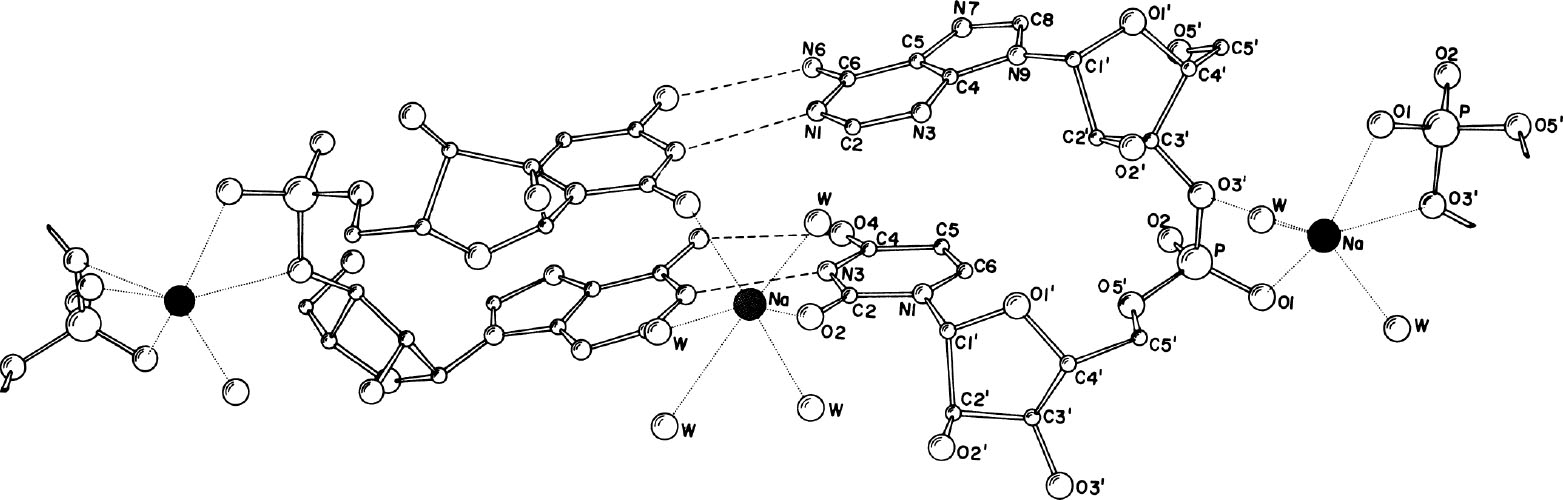
图3. 从(DNA双螺旋的)小沟上观察到的透视结构图,显示了核苷酸中原子的编号和钠离子形成的配位结构。两个钠离子(●)均参与形成扭曲的八面体配位,参与成键的原子还有水分子和其他氧原子。位于中心的那个钠离子距离尿嘧啶的O2原子的距离是2.36 Å。
从图1中可以看到这些分子的螺旋形态,在此图中,读者的观察方向与碱基对平面垂直。图中前方和后方的碱基对的糖苷键(C1′到腺嘌呤N9或C1′到尿嘧啶N1)之间存在明显的旋转关系。图2则显示了从平行于以氢键连接的堆积碱基的方向观察到的结构。通过观察核糖磷酸链上的相邻核糖残基的取向,我们可以很容易地看出该分子的右手螺旋结构。这一结构与研究双链病毒RNA推导出的结构相似。这种天然形成的分子被称为RNA 11。图2显示了ApU和RNA 11之间的类似结构,其中垂直的虚线表示近似的螺旋轴。ApU核苷酸对的持续延伸将会形成一个类似于RNA 11的右手双螺旋。值得注意的是,尽管RNA 11的螺旋参数可以从RNA纤维的X射线分析中直接得到,但是其中那些原子中心的位置必须从小分子的单晶体研究数据中得到,而无法直接观察到。 英文
尽管在不对称单元中的两分子ApU非常相似,但它们并非完全相同。它们的键长和键角均在预期范围内。核糖残基的构象均为3′–内向 [19] ,而核苷基团的取向则为反向构象 [20] ,其中糖苷键 [19] 对于腺苷残基的扭转角为2º和7º,对于尿嘧啶则为29º和30º。与质子化的UpA结构 [21,22] 进行比较表明,腺嘌呤和尿嘧啶在扭转角上的差异是由于分子的3′和5′端之间的差异而引起的;因为在具有相反碱基序列的分子中也观察到了类似的3′和5′端的差异。 英文
在UpA的质子化结构中,人们注意到了腺苷的C8和O5′之间以及尿嘧啶的C6和O5′之间的距离都很短(文献14)。当时有人提出,这可能是分子内吸引的结果。如果这种吸引力普遍存在的话,它有助于核苷酸反向构象的稳定。因此,人们怀着浓厚的兴趣对该结构中的相关距离进行了研究。在4种独立距离中,有3种大于或等于3.3 Å;因此,没有证据表明发生了任何相互作用。但腺嘌呤的C8与其核糖O5′的距离是3.07 Å,由于这个O5′与磷原子并非共价相连,这一现象可能与核苷酸是否位于螺旋状的多聚核苷酸链上无关。尽管如此,对于非螺旋的和有3′端的核酸结构而言,这种相互作用可能仍然起着重要作用。 英文
每一个双螺旋片段都以3.4 Å的距离分布在晶格上,其腺嘌呤残基之间存在相当程度的重叠。除了这种分子之间的碱基堆积外,另一种重要的相互作用存在于碱基对的垂直方向上,由两个腺苷的核糖中的O1′与两个尿嘧啶环之间的相互接近而产生。人们发现在UpA晶体中有一种类似的相互作用也十分重要 [21,22] 。 英文
晶体结构可以被看作是一种类似杆状的实体。这些杆状实体的中心部分为堆积的碱基对,两侧为核糖磷酸骨架,而这两条核糖磷酸骨架又被溶剂结构所包围。大量的水的存在使得晶体结构呈现出一种构象,该构象可以使晶格之间的扰动降到最低。因此,我们这里所观察到的双螺旋结构与那些溶剂化的多聚核苷酸的结构之间存在显著的相似性。不过,应当顺便提出的是,核酸分子相当牢固地结合了水,因为晶体的衍射强度数据是将其置于空气中时采集的。 英文
核糖磷酸链组装在一起,磷酸基团两两相对。在两个核糖磷酸的中间层内,钠离子存在于两个位点:其一是络合在磷酸基团之间,另一个则是出乎意料地与尿嘧啶残基络合。钠离子及其配体见图3。钠离子位于双螺旋小沟的伪二次轴上,以其为中心,可以与包括尿嘧啶的自由O2原子和水分子形成八面体配位。如图3所示,另一个钠离子位于分子内的伪二次对称轴上,同样以八面体配位形式存在,参与配位的包括两个腺苷的O3′原子和两个磷酸基团上的氧原子。 英文
从静电学角度就能很容易地理解钠离子可以稳定存在于两个磷酸基团之间。然而,我们不清楚的是为何第二个钠离子与螺旋小沟的两个尿嘧啶络合。距离这一位点5 Å处,在两个磷酸基团之间有另一位点,完全可以容纳钠离子,但是该位点仅被溶剂分子所占据。该结构的稳定性很大程度上可能是通过位于小沟上的钠离子而实现的。如果能证明在其他包含A–U序列的晶体中这一现象也常见的话,这种类型的配位可能对多聚核苷酸的结构和功能起重要的作用。 英文
正如以上所言,ApU晶体结构组织的最显著的特征是,位于不对称单元中的两个独立分子之间具有非常相似但不完全相同的构象。因此,尽管在这里它们是以一条伪二重旋转轴相关联,但当处于一条反向平行的双螺旋多聚核苷酸中时,应该有一条真正的二重轴把两条反向平行链的骨架关联起来。我们还没有完全理解为何ApU的晶体结构没有采用真正的二重轴。不过,关于这一点,我们最近发现与之密切相关的二核苷磷酸,鸟苷–3′,5′–胞苷磷酸在晶体状态下确实形成了右手反向平行双螺旋,且形成的是晶体学二次轴(戴、西曼、罗森堡和里奇的未发表成果)。此前我们强调了伪二次轴对该晶体结构的重要性,这一近期结果支持了我们的结论。 英文
我们通过分析双螺旋片段所得到的重要结果有,确定多聚核苷链构象的重要详细参数,特别是关于磷酸基团几何结构的部分。核糖磷酸链的结构对于理解多聚核苷酸链的物理性质和行为都至关重要 [23] 。对于解释多聚核苷酸双螺旋以及形式更为复杂的RNA中的(如在tRNA中观察到的)分子结构细节,这些信息将会非常有价值 [24] 。 英文
此研究得到了国立卫生研究院、国家科学基金会和美国癌症协会的经费资助。西曼是戴蒙·鲁尼恩基金会的博士后学者,罗森堡是国立卫生研究院的博士前实习生,苏达茨是美国癌症协会的博士后学者,尼古拉斯是国立卫生研究院的博士后学者。 英文
在此我们感谢鲍勃·罗森斯坦、罗伯塔·奥格尔维·戴、唐·哈特菲尔德、金圣浩和加里·奎格利的有益讨论和鼓励,以及约翰·吉诺瓦和蒂姆·奥马拉的技术支持。 英文
(周志华 翻译;昌增益 审稿)