




 盐生盐杆菌中类感光色素的共振拉曼光谱
盐生盐杆菌中类感光色素的共振拉曼光谱
门德尔松
编者按
嗜盐光合细菌盐生盐杆菌(及相关生物)的紫膜中含有细菌视紫红质蛋白,能够利用所吸收光的能量,使氢离子(质子)穿过中央通道,在膜两侧产生酸度梯度,进而被开发为化学能。这个系统已成为研究生物能量转化和质子转移的原始模型,还引发了研究太阳能技术的兴趣。伦敦国王学院的理查德·门德尔松利用光谱确定了蛋白质中心光敏化学基团光吸收的基本过程。这些基团中光化学变化如何导致质子转移的细节仍需进一步阐明。 英文
共振拉曼技术的使用表明,盐生盐杆菌紫膜色素的颜色来自于一种未质子化的席夫碱,该碱的电子密度受到蛋白质的远程(静电)相互作用的干扰。发色团可能包含一个由视黄基赖氨酸与蛋白质的适当支链构成的电荷转移复合体。 英文
共振拉曼光谱已被报道应用于多种具有生物学意义的分子,其中包括血红蛋白 [1,2] 、细胞色素C [2,3] 、红素氧还蛋白 [4] ,以及几种胡萝卜烯 [5] 和视黄醛 [6,7] 。分子在受到能引起电子跃迁的波长的光的激发时,其特征拉曼活性振动就会共振增强 [8] ,这种效应提供了一种极低浓度下的结构探针。对于生物体系来说尤为重要的是它使原位检测变得可行。 英文
感光色素就是这种技术的潜在应用领域之一。视色素的红移现象目前尚没有令人满意的解释。这些色素的最大吸收峰位于430 nm到562 nm(参考文献9),显示其中含有由赖氨酸残基中的ε-氨基基团和11-顺式视黄醛所形成的席夫碱。而席夫碱的溶液,根据氮原子未被质子化与质子化的不同,其对应的吸收峰分别位于360 nm和440 nm附近。由此,蛋白质与发色基团之间的另一特定相互作用的出现,干扰了发色基团的吸收带,从而产生了色素的颜色 [10] 。阿伯拉罕森和奥斯特罗伊 [11] 曾综述了几种解释视色素光谱的理论。其中最重要的两种是:(1)莫顿等 [12,13] 提出,假定主价键为质子化的席夫碱,其中多烯链邻近适当位置上的负电子基团导致了红移;(2)达特诺 [9] 的说法,假定主价键为未质子化的席夫碱,其中处于最优位置上的电子对引发二次频移,在多烯上生成大量偶极。几乎没有实验证据可用来验证任一理论。 英文
由于对含视紫红质样品进行强激光照射会产生大量可预期的光化学变化,笔者决定首先研究盐生盐杆菌中的类感光色素。包含色素的“紫膜”碎片为激光–拉曼光谱的研究提供了几个有利条件。( a )发色基团的主要结构是视黄基赖氨酸,提供的证据对于视紫红质差不多同样有效 [14] 。( b )与视紫红质不同,这种色素即使长期暴露在强烈(>200 mW)激光中也不会脱色或发生光化学变化,当暴露在红光或蓝光中,在两种光之间只会发生可逆的光谱频移,由λ ma x =558 nm移到λ ma x =570 nm [14] 。( c )这种膜在室温下的水悬浮液中很容易处理。 英文
这里描述的本研究中所用的紫膜,为厄斯特黑尔特和布劳罗克两位博士所赠。 英文
培养盐生盐杆菌和分离紫膜碎片的方法如先前所述 [14] 。用于拉曼光谱检测的膜悬浮液在最大吸收峰λ max 处光密度为3.0。 英文
图1所示为分别以4880 Å和5145 Å的射线激发紫膜碎片的拉曼光谱。每张谱图中,都有一个位于1,531 cm –1 处的最强振动,以及其他约十五个可分辨出的峰。两张谱图中唯一的显著区别,就是位于1,568 cm –1 处的振动与1,531 cm –1 处的相比,其相对强度不同。用4880 Å的射线激发时,1,568 cm –1 处的峰比用5145 Å的射线激发时强约四倍。下面将解释这一观测结果。 英文

图1. 使用“Spex”1401型拉曼光谱仪,得到紫膜碎片水悬浮液(紫色蛋白质浓度为5.5×10 –5 M,pH 7.0,不含缓冲剂)的拉曼光谱图:(上图)100 mW Ar + 激光产生的4880 Å射线。分辨率7 cm –1 ;时间常数2 s;扫描速率25 cm –1 ·min –1 ;光子计数检测;1 mm内径的毛细管池,横向激发。(下图)125 mW Ar + 激光产生的5145 Å射线。其他条件同上。偏振测量指出,所有观测到的振动具有的退偏比值为0≤ρ≤0.3。悬浮于4 N NaCl溶液中的膜碎片的谱图与所示谱图是一致的,在0.05 M磷酸盐缓冲溶液(pH 7.0)中得到同样的谱图。
若干实验表明观测到的谱图有共振增强。(
a
)通过可见光谱测定(ε
ma
x
=54,000 L·mol
–1
·cm
–1
)
[14]
的蛋白质浓度为5.5×10
–5
M,或者说,比要获得正常的蛋白质拉曼光谱所需的浓度低两个数量级
[15]
。(
b
)若使用0.1 M的溴化十六烷基三甲铵(pH 7.9)使色素脱色,这个过程可以使席夫碱保持完好但破坏紫色
[14]
,导致不能观测到光谱。(
c
)激发曲线(拉曼强度随着激发波长的变化)实验步骤如下。在膜样品中加入0.1 M的Na
2
SO
4
,以
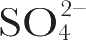 离子在983 cm
–1
处的没有共振增强的对称伸缩振动作为内标。测定以位于1,531 cm
–1
处和1,568 cm
–1
处峰强度与内标强度的比值作激发波长的函数;光源是氩离子激光,可以产生六条都位于色素吸收带高频端的谱线。结果如图2所示。很明显,确实存在着对于散射光强度的1/λ
4
定律的严重偏离,因为如果遵循该关系的话,所观测到的比值是不会随波长而变化的。所研究的两种振动看来是为膜吸收光谱中不同部分的(电子振动)耦合所增强的。随着激发光波长向着色素的λ
max
方向的增长,位于1,531 cm
–1
处峰的相对强度会增加。由此与主要色素吸收耦合起来。不过,位于1,568 cm
–1
附近的吸收带相对强度随着激发光波长减少而增加,因此不会与膜光谱的可见部分耦合,而是与位于比主吸收带波长短的吸收部分耦合。
英文
离子在983 cm
–1
处的没有共振增强的对称伸缩振动作为内标。测定以位于1,531 cm
–1
处和1,568 cm
–1
处峰强度与内标强度的比值作激发波长的函数;光源是氩离子激光,可以产生六条都位于色素吸收带高频端的谱线。结果如图2所示。很明显,确实存在着对于散射光强度的1/λ
4
定律的严重偏离,因为如果遵循该关系的话,所观测到的比值是不会随波长而变化的。所研究的两种振动看来是为膜吸收光谱中不同部分的(电子振动)耦合所增强的。随着激发光波长向着色素的λ
max
方向的增长,位于1,531 cm
–1
处峰的相对强度会增加。由此与主要色素吸收耦合起来。不过,位于1,568 cm
–1
附近的吸收带相对强度随着激发光波长减少而增加,因此不会与膜光谱的可见部分耦合,而是与位于比主吸收带波长短的吸收部分耦合。
英文

图2. 激发曲线结果。---,1,568 cm
–1
处振动峰强与作为内标的
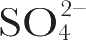 在983 cm
–1
处振动峰强的比值。…,1,531 cm
–1
处振动峰强与同样的内标峰强的比值。■和●为在上述激光波长条件下观测到的实验值。误差线代表基于四次实验得到的标准偏差。插图为紫膜的色素吸收带。垂直线表示位于457.9 nm、472.7 nm、488.0 nm、496.6 nm、501.7 nm和514.5 nm的激光束。可见光吸收光谱是由“Unicam”SP-800A光谱仪使用2 mm路径长度的样品池得到的。
在983 cm
–1
处振动峰强的比值。…,1,531 cm
–1
处振动峰强与同样的内标峰强的比值。■和●为在上述激光波长条件下观测到的实验值。误差线代表基于四次实验得到的标准偏差。插图为紫膜的色素吸收带。垂直线表示位于457.9 nm、472.7 nm、488.0 nm、496.6 nm、501.7 nm和514.5 nm的激光束。可见光吸收光谱是由“Unicam”SP-800A光谱仪使用2 mm路径长度的样品池得到的。
所有的其他振动(除了1,646 cm –1 处归属为溶剂O—H的振动外)都具有与1,531 cm –1 处振动类似的振动方式,因此也是由与色素560 nm处吸收带的耦合产生的。 英文
在共振拉曼效应中只能观测到发色团的振动这一事实简化了谱图分析 [1-3] 。蛋白质振动的强度尚不足以被看到,因而不会使谱图复杂化。在本工作中要考虑的是包含C=C与C=N伸缩振动的1,500~1,700 cm –1 区域。低于1,500 cm –1 的包含C—C伸缩振动与C—H弯曲振动的区域,将会在以后的发表物中进行讨论。 英文
里毛伊与他的同事们已经对各种视黄醛 [7] 及其席夫碱 [6] 的拉曼光谱进行了详细研究。他们发现,增强最明显的是在共轭链中的C=C和C—C伸缩振动,分别位于大约1,570 cm –1 和1,200 cm –1 处。另外,他们还在1,600~1,670 cm –1 区域中指认出C=O和C=N的伸缩振动。 英文
在图3 a 和3 c 中所示分别为未质子化的和质子化的视黄基己胺拉曼光谱图的1,500~1,700 cm –1 区域。在这种形式的席夫碱中,预期C=N的振动频率会与视色素席夫碱中的相似,从而可用于确定后者中的氮原子是否被质子化。在未质子化的形式中(图3 a ), v (C=N)为位于1,623 cm –1 附近的一个弱吸收带,而位于1,579 cm –1 处的 v (C=C)看起来很强。在质子化了的视黄基己胺中(图3 c ),C=N伸缩振动峰增宽并移向1,645 cm –1 处,而 v (C=C)则移向1,559 cm –1 处。 英文

图3. 拉曼光谱图的1,500~1,700 cm –1 区域,其中 a ,未质子化的视黄基己胺(浓度10 –3 M的C 6 H 14 溶液,λ max =360 nm); b ,紫膜碎片在水中的悬浮液(见图1的上图,图注); c ,质子化的视黄基己胺(浓度10 –4 M的酸化乙醇溶液,λ max = 445 nm); d ,紫膜碎片在D 2 O中的悬浮液(除溶剂外,条件与图1的上图相同)。所有谱图都是在4880 Å光照射下记录的。在 a 和 c 之间的浓度差别反映出,共振增强在视黄基己胺的吸收带向可见光区域移动时变大。这种席夫碱在不同溶剂下其拉曼频率改变很少甚至没有变化。在已提到的溶剂中获得了未质子化和质子化的视黄基己胺的最佳谱图。
图3 b 中所示为紫膜光谱的1,500~1,700 cm –1 区域。这个区域由于有1,646 cm –1 处的溶剂OH产生的微弱的弯曲振动出现而复杂化了,不过位于1,531 cm –1 、1,568 cm –1 、1,602 cm –1 和1,623 cm –1 处的峰还是明显可见。位于1,568 cm –1 处的峰归属于席夫碱的 v (C=C)。前面描述过的激发曲线实验结果指出,这种振动来自于视黄基赖氨酸,而不是色素中的振动。尚不清楚这种游离的席夫碱对于色素结构是否有重要意义。至于紫膜在D 2 O中的悬浮液,1,646 cm –1 处的吸收带如同预期那样地消失了,而1,623 cm –1 附近的振动变得比水溶液中的更显著(图3 d )。这一归属于席夫碱中C=N伸缩振动的吸收带,显示与未质子化的视黄基己胺中振动频率相同,从而强烈暗示着色素中的席夫碱是未质子化的。 英文
紫膜拉曼光谱中位于1,531 cm –1 处的最强峰在模型席夫碱的谱图中找不到对应峰,后者在1,550 cm –1 以上有很强的C=C伸缩振动峰。1,531 cm –1 吸收带的强度暗示着对于色素吸收存在强烈的电子振动耦合,并且指出,从其数值和位置来看,该振动仍是源于视黄基中的C=C伸缩。频率的降低意味着共轭系统中π电子密度受到扰动以及电子远离了C=C键。这一过程将会减小C=C伸缩的力常数并降低 v (C=C)。 英文
上述观测指出,色素颜色来自于一种未质子化的席夫碱,该碱的π电子密度受到其与蛋白质的远程(静电力)相互作用干扰。当注意到紫膜的λ max 是高度依赖于溶剂时(麦克莱尔,个人交流)就得到了支持这一陈述的另一证据。加入少量氯仿能够使色素的λ max 可逆地移向500 nm,而主拉曼频率移至1,520 cm –1 处。氯仿似乎渗透进了发色团并以此干扰其电子排布。 英文
紫膜色素的具体的几何形状还得等待其三维结构的确定;但是,本研究所针对的模型是一个由视黄基赖氨酸与蛋白质的适当支链构成的电荷转移复合体 [16] 。这种相互作用可以解释发色团λ max 的巨大位移(从360 nm到约560 nm),以及复合体形成后对发色团振动频率的干扰。此外,就目前所观测到的来说,这种复合体中的λ max 是非常依赖于溶剂的 [16] 。石上等 [17] 已经说明了这一机制的可能性,他在酸化的甲醇溶液中观测到色氨酸与9–顺式视黄醛的电荷转移(该复合体的λ max =520 nm)。而且,笔者曾观测到吲哚与反式视黄醛(λ max =625 nm)在相同溶剂中的电荷转移。因此,极有可能是处于蛋白质适当位置上的色氨酸残基与席夫碱的π电子相互作用并产生了紫色素的颜色。 英文
对视紫红质及其在低温脱色过程中出现的中间体的拉曼光谱研究,能获得关于决定色素颜色的席夫碱–蛋白质相互作用本质的宝贵信息。本工作描述了这种研究的可行性,以及共振拉曼技术为感光色素提供结构探针的能力。 英文
我要感谢布劳罗克、利布、麦克莱尔这几位博士所做的详细讨论。本研究由加拿大国家研究委员会赞助。 英文
(王耀杨 翻译;李芝芬 审稿)