





肾脏病的发生、发展与免疫反应有极为密切的关系,各种免疫学检查对肾脏病的病因、病理、治疗及预后的判断均有重要意义。下面主要从细胞免疫学、体液免疫学及肾组织的免疫学三个方面进行介绍。
1.方法
IgG、IgA、IgM在血清中含量较高,目前临床上多采用单向免疫扩散法测定。IgD的测定目前一般实验室仍用单向免疫扩散测定,但敏感性太低,故选用ELISA法测定较为准确可靠。至于在血清中含量极微的IgE,一般均采用敏感性较高的ELISA法放射免疫技术测定。
2.正常值
不同测定方法及不同年龄的小儿血清免疫球蛋白(immunoglobulin)的含量不一,见表5-12。
表5-12 不同年龄血清免疫球蛋白水平
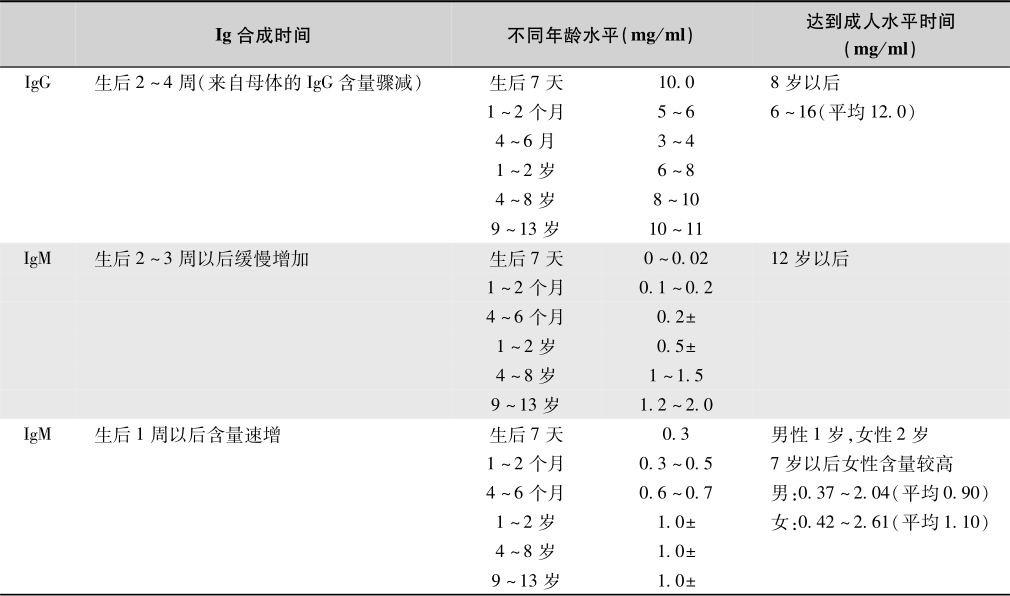
注:摘自钱玉昆.免疫学(下册).北京医学院微生物教研组
3.临床意义
(1)急性肾小球肾炎:
IgG、IgA轻度升高,IgM正常或稍增高。
(2)慢性肾小球肾炎:
若临床表现为肾病综合征,则IgG与IgA下降,IgM多正常。肾功能不全时IgG下降。
(3)肾病综合征:
单纯型活动期肾病综合征患儿,血清IgG、IgA明显下降、IgM增高;缓解期IgG、IgA可逐渐得以恢复。此外,微小病变型肾病IgE增高。
(4)狼疮性肾小球肾炎:
IgG、IgM可升高,但当合并肾病综合征时,则IgG、IgA降低。
(5)IgA肾病及过敏性紫癜肾炎:
部分患儿血清中IgA可见有升高。
但遗传性缺陷、年龄、营养状况、环境、药物以及疾病持续时间与病期或是否合并其他感染等因素均可影响Ig的分析,临床上应引起重视。
1.测定方法
所有的血清补体(serum complement)成分均为糖蛋白,整个补体系统至少由13个成分及8个调节蛋白构成。血清中C 3 浓度最高,其次为C 4 、C 1q 及B因子。目前,补体主要测定方法如下。
(1)单向免疫扩散法:
用于测C 3 、C 4 、C 5 、C 1q 、裂解素、B因子等单一补体成分。
(2)免疫电泳法:
主要用于C 3 肾炎因子(C 3 NaF)的测定。
2.正常值
单一补体成分血清浓度见表5-13。
表5-13 正常人单个补体成分血浆参考浓度(mg/L)
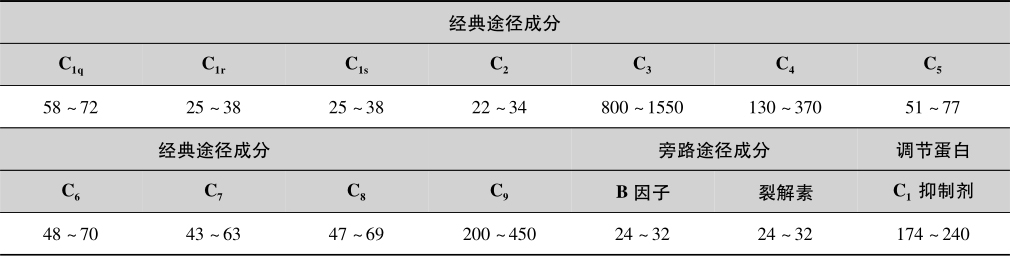
注:根据廖二元《最新临床检验手册》(湖南科学出版社出版
3.临床意义
(1)微小病变型肾小球肾炎、系膜增殖型肾小球肾炎、IgA肾病、膜性肾病、Good-Pasture综合征等,血清补体通常无明显改变。
(2)突发性肾病患儿可有C 1q 降低。
(3)急性链球菌感染后肾小球肾炎疾病早期C 3 下降,C 2 、C 4 也可降低,若无并发症,6~8周后又可恢复至正常状态。
(4)膜增殖型肾小球肾炎中部分病例可出现持续性低补体血症,C 3 、裂解素、B因子均下降,并可检测到C 3 NaF。若表现为急性肾炎综合征,可检测到C 3 NaF。若表现为慢性肾炎综合征,则为持续性低补体血症;若为肾病综合征激素敏感患儿,则C 3 、C 4 、C 5 升高,C 9 、B因子下降。
(5)狼疮性肾炎:C 3 、C 4 下降,缓解期可恢复正常。
1.相关抗体的测定方法
(1)血清法:
用于检测抗链球菌溶血素“O”(ASO)。
(2)间接血凝法:
用于检测抗DNA抗体、抗ENA抗体。
(3)LE细胞试验:
用于测定抗DNP抗体。
(4)放射免疫分析法:
用于测定抗肾小球基底膜(GBM)抗体、抗肾小管基膜(TBM)抗体、抗Tamm-Horsfall(T-H)等蛋白抗体。
(5)间接免疫荧光试验:
可用于测定抗GBM抗体、抗TBM抗体。
(6)酶联免疫吸附试验:
主要用于检测抗TBM抗体。
2.正常值
根据不同的实验方法及条件不同而略有差别,各实验室应根据自身情况确定正常值。
3.临床意义
(1)“ASO”的测定对链球菌感染后肾小球肾炎的诊断起重要作用,ASO在感染后10~14天升高,3~5周达高峰,于3~6个月后逐渐恢复正常。
(2)抗核抗体是诊断SLE肾炎不可缺少的指标,SLE活动期抗核抗体滴度多在1∶160以上,病情稳定或好转后滴度下降。
(3)检查血清或肾洗脱液中抗GBM抗体是诊断原发及继发抗GBM肾炎的必要手段。
(4)抗T-H蛋白抗体检查是鉴别上、下尿路感染的重要指标。
(5)抗TBM抗体检测有助于诊断肾小管间质肾炎。
1.测定方法
(1)根据其物理性状(分子量大小),检测方法有:①蔗糖密度梯度离心法;②凝胶过滤,超滤技术。
(2)根据循环免疫复合物(circulating immune complex,CIC)的生物学活性的测定方法有:①C 1q 结合试验(放射免疫法或ELISA法);②Raji细胞放射免疫分析法;③胶固素结合试验(放射免疫分析法、ELISA法);④类风湿因子(RF)结合试验:包括RF凝胶弥散试验、RF定量沉淀试验及RF放射免疫试验;⑤金黄色葡萄球菌A蛋白(sPA)结合试验(ELISA法);⑥血小板凝集试验;⑦抗补体活性试验;⑧聚乙二醇沉淀-补体消耗试验。
2.临床意义
由于CIC在许多情况下均可增高而又与肾病无关,而一些原位免疫复合物肾炎CIC并不高,加之检测方法可靠性较差。因此,循环免疫复合物测定,在肾脏病临床应用上价值有限。但其对监测某些循环免疫复合物性肾炎的活动性有极其重要的意义。如狼疮性肾炎、急性感染后肾炎、急进性肾炎Ⅱ型、感染性心内膜炎肾损害及反流性肾炎等。
1.测定方法
在37%下取血及分离血清,将血清置4℃1~3天观察有无沉淀,若有沉淀则离心分离,用生理盐水悬浮后复温(37℃ 30分钟),若复温后沉淀物溶解则证实冷球蛋白(cryoglobulin)存在。此后可进一步检查其免疫球蛋白的种类及抗体活性。
2.正常值
正常情况下为阴性结果。
3.临床意义
除Ⅰ型(单株冷球蛋白)外,Ⅱ、Ⅲ型冷球蛋白本身为免疫复合物,可通过免疫机制致肾病;再则,冷球蛋白极易形成微血栓加重肾损害。因此,临床检测血清冷球蛋白具有十分重要的意义。
C 3 是补体第三成分,也是补体系统中含量最高、作用最关键的成分。其是连接补体激活经典途径与旁路途径的枢纽。C 3 为一种β 1 C球蛋白,分子量为180 000,半衰期为47.5~69.5小时,主要由肝细胞合成与分泌,巨噬细胞和单核细胞也能合成。正常情况下,尿C 3 检查为阴性。当免疫复合物沉积于肾小球、激活补体引起肾小球损伤时,血中C 3 自基底膜漏出而出现于尿中。故尿C 3 测定可帮助鉴别肾小球基底膜的损害。常用单向免疫扩散法测定尿C 3 。
正常人及非肾小球疾病患者尿C 3 阴性。膜增生性肾小球肾炎、SLE肾炎的绝大多数患者能检出尿C 3 。膜性肾病和局灶节段性肾小球硬化的尿C 3 检出率也很高。微小病变型常为阴性,有人将尿C 3 测定与蛋白尿选择性的检查结果相比较。认为SPI﹥0.2者尿中排出C 3 的机会显然大于SPI﹤0.1者。此外,尿C 3 测定具有判断激素疗效及预后的意义。如肾病综合征尿C 3 阴性者比阳性者对泼尼松治疗明显地要敏感。尿C 3 阳性者较阴性者病情重、预后差,其含量与病情严重程度有关。
抗中性粒细胞胞质抗体(anti-neutrophilic cytoplasmic antibodies,ANCA)是针对中性粒细胞胞质中的抗原物质而产生的一种自身抗体。1982年,Davies等首先报道在血管炎患者血清中检出。1985年,Van Der Woude等报道在Wegener肉芽肿患者血清中测得。以后相继在结节性多动脉炎、新月体肾炎、IgA肾病等患者血清中检出。ANCA对Wegener肉芽肿有明显的特异性,阳性率为52.3%~58.6%,活动期Wegener可达80%。至今已有许多有关ANCA测定与肾脏疾病诊断的研究。
应用间接免疫荧光技术(IF)可将ANCA分为胞质型ANCA(cANCA)及核周型ANCA(pANCA)两种类型,前者是以细胞质内均匀荧光染色为特征,后者是以细胞核周围荧光深染为特征。众多的研究结果显示,中性粒细胞胞质颗粒中的蛋白酶3(PR3)是cANCA识别的主要靶抗原,而颗粒中的髓过氧化物酶(MPO)是pANCA识别的主要靶抗原。此外,弹性蛋白酶、溶菌酶、组织蛋白酶G以及乳铁蛋白也可作为ANCA的抗原成分。
1.检测方法
ANCA检测方法有多种,一般有间接免疫荧光法(1F)、放射免疫测定法、酶联免疫吸附法(ELISA)。
(1)抗PR3抗体:
多见于Wegener肉芽肿及微型多动脉炎(MPA)等,抗MPO抗体则主要是与累及肾脏的血管炎相关。IF-ANCA阳性除见于新月体肾炎、MPA外,还可见于胶原血管病、风湿性疾病、溃疡性结肠炎、自身免疫性肝炎以及某些肿瘤等。单纯间接免疫荧光下ANCA阳性的诊断价值极为有限,应在此研究基础上进一步检测ANCA的特异性抗原成分j,尤其是PR3及MPO。对于间接免疫荧光检测ANCA阳性,而抗MPO或抗PR3抗体阴性者,其ANCA的诊断价值有待于进一步研究。
(2)IF-ANCA和MPO-ANCA同步检测的临床意义:
由于IF-ANCA不能特异性分析ANCA的靶抗原,而且敏感性和特异性均可受到多种因素的影响,不能为临床诊断和鉴别诊断提供可靠的实验室依据,黎磊石等开展了IF-ANCA和MPO-ANCA同步检测的研究。结果表明MPO-ANCA检测的敏感性高于IF-ANCA,同步检测可以提高肾血管炎的诊断价值,减少假阳性,去除外界因素的干扰。若两法同步检测血清ANCAI阳性,往往高度提示肾血管炎,如MPA肾损害、紫癜性肾炎、Ⅲ型新月体肾炎和IgA肾病等。
细胞免疫参与肾炎发病的机制正越来越被高度重视。T细胞介导引起肾免疫性损伤包括:①引起迟发性变态反应,产生以单核细胞浸润为主的局灶性炎症反应;②释放大量淋巴因子,吸引、激活其他各种吞噬细胞而产生病变;③细胞毒(杀靶细胞)作用;④T-B细胞间相互作用。此外,T细胞在免疫功能调节中也起重要作用。如当辅助性T细胞(Tn细胞)与带有抗原决定簇的抗原特异性协助因子MHC(主要组织相容性复合体)Ⅱ类作用后,会产生许多淋巴因子来调节免疫系统。T源淋巴因子又可导致一系列介质的释放,如白细胞介素-2(IL-2)至IL-7、大量γ-干扰素、生长因子等。以上各类物质又将进一步刺激病灶间的单核-巨噬细胞、T及淋巴细胞增生、成熟、分化,并与这些炎性细胞共同损害肾间质的结构与功能。
目前已有证据表明:急性肾炎、无明显免疫球蛋白沉积的特发性新月体肾炎、抗GBM性肾炎、韦格纳肉芽肿等,有突出的细胞免疫机制在起作用。另外,在微小病变性肾病中,尚未发现有体液免疫作用的证据,却有T细胞功能如其克隆形成能力及刺激因子异常等。根据参与细胞免疫反应的细胞的表面受体及产生的淋巴因子等特性可以检测免疫活性细胞的数量及功能,并以此来判断机体内细胞免疫功能状态,为临床提供诊断和治疗依据。
1.测定方法
人类T淋巴细胞表面存在绵羊红细胞(SRBC)受体,在体外可与数个绵羊红细胞结合形成玫瑰花结。高倍镜下计数100个淋巴细胞,吸附3个以上绵羊红细胞者为玫瑰花结形成细胞,并求出其百分率。
2.参考值
0.40~0.70(40%~70%)。另据J.F.Soothill等,新生儿为0.42~0.60(42%~60%),儿童及成人为0.54~0.80(54%~80%)。
3.临床意义
E-RFC可代表机体T淋巴细胞总数RFC下降,可反映细胞免疫功能降低。恶性肿瘤者29%RFC明显下降,伴淋转率下降。经抗癌治疗后则回升。慢性肾炎、SLE、干燥综合征、慢性迁延性肝炎、肝硬化及多种病毒感染(如麻疹、水痘、腮腺炎等)急性期等疾患时T细胞减少,E-RFC有不同程度下降。
1.方法
在患儿左前臂中1/3与下1/3交界处掌侧皮内注射PHA 67pg/0.1ml(PHA为冻干粉剂,需用生理盐水稀释),于注射后24小时观察局部皮肤反应,并测量红斑及硬结的直径。
2.参考值
以红斑平均直径≥5mm为阳性,﹤5mm为阴性。
3.临床意义
(1)非肿瘤者细胞免疫功能不全时反应阴性,如结节病、麻疹、风疹等。肿瘤患者随病期发展逐步抑制,与预后有关,晚期恶性肿瘤者绝大部分为阴性反应。
(2)肾脏病患者阴性者,表示抵抗力较差、容易并发细菌或病毒感染,故应用免疫抑制剂时应慎重,切勿过量,必要时加用免疫促进剂以增加免疫力。
(3)反映某些肾脏疾病的活动情况,如狼疮肾炎常为阴性,缓解期可转阳性。肾炎晚期肾衰竭常为阴性。
1.测定方法
用OKT系列株产生的OKT3、OKT4、OKT8等抗人T细胞的单克隆抗体以间接免疫荧光法,测定T淋巴细胞数并进行免疫分型。OKT3单克隆抗体针对的是辅助性T细胞(TH)及抑制性T细胞(Ts),故可测得T和Ts细胞总量;OKT4和OKT8分别为抗TH和Ts细胞的抗体,可以分别测定这两种T细胞数。此外,测定外周血T淋巴细胞亚群还可用直接SPA(金黄色葡萄球菌A蛋白)菌花环法和间接SPA菌花环法。
2.参考值
(1)间接免疫荧光法:
OKT3 0.72±0.06[(71.5±6.20)%]
OKT4 0.46±0.05[(45.7±5.27)%]
OKT8 0.28±0.05[(27.9±5.01)%]
OKT4/O KT8 1.66±0.33
(2)直接菌花环法:
OKT3 0.68±0.06[(67.7±6.22)%]
OKT4 0.43±0.04[(42.9±4.09)%]
OKT8 0.27±0.04[(27.0±4.10)%]
OKT4/OKT8 1.58±0.27
(3)间接SPA菌花环法:
OKT3 0.69±0.06[(69.1±6.28)%]
OKT4 0.44±0.05[(44.0~5.46)%]
OKT4/OKT8 1.65±0.26
3.临床意义
(1)单纯性肾病综合征患儿在肾病活动期OKT4活性减低,OKT8活性升高。病情稳定后OKT4活性升高,OKT8活性下降。
(2)肾炎性肾病伴有HBsAg阳性者,OKT4/OKT8显著下降。
(3)AIDS时,OKT4/OKT8比值显著降低。
(4)此时,传染性单核细胞增多症及其他一些急性Ⅰ型变态反应性疾病等,T细胞数增多。SLE、类风湿性关节炎及干燥综合征等,T细胞减少。
白细胞介素-2(IL-2)为T淋巴细胞受抗原或致分裂原刺激后所分泌的一种重要的淋巴因子(T细胞生长因子),分子量为15 000,具有重要的免疫调节活性。
1.参考值
外周血淋巴细胞IL-2活度为(29.5+13.5)kU/L。
2.临床意义
IL-2在机体免疫应答中具有关键性作用,其可使活化的T淋巴细胞分裂增殖,加强Tc细胞(细胞毒T细胞)、NK细胞的杀伤功能,活化LAK前体细胞,辅助抗体生成。T 4 细胞是分泌IL-2的主要细胞群,而T 8 细胞则抑制其合成。
免疫组织化学(immunohistochemistry)具有灵敏度高、特异性强、定位准确及应用广泛等特点。免疫组织或细胞化学的基本原理有三种:①抗体与某种荧光化合物结合,孵育后抗原即与有标记的抗体接触,然后在荧光显微镜下观察,也就是通常所说的免疫荧光检查;②抗体与过氧化物酶结合,在抗原抗体反应后,将标记物提取过氧化物酶的组织化学方法处理,在光镜或电镜下观察;③抗体与铁蛋白结合,抗原抗体反应后,用电镜观察。
1.反应原理
该方法包括直接法和间接法。
(1)直接法:
将荧光素标记在一抗上,直接测定相应抗原。
(2)间接法:
将未标记荧光素的一抗与抗原作用,使其成为抗原-抗体复合物,然后用荧光标记的二抗染色,即成为发荧光的抗原-抗体-抗抗体复合物。
2.方法与步骤(间接法)
(1)取材:
肾组织取材后应立即置于液氮中保存或放入10%甲醛固定液中固定(石蜡包埋)待用。
(2)切片:
Cryostat切片(温度在12~14℃下),切成10μm,或石蜡切片,厚3~5μm,在载玻片中展平,室温空气干燥。
(3)固定或脱蜡脱水:
冷冻切片用预冷氯仿-甲醇(2∶1)0℃下固定20分钟,石蜡切片则脱蜡、脱水。
(4)洗涤:
用0.1mol/L预冷PBS(pH 7.4)洗3次,双蒸水洗涤脱盐,然后风干。
(5)消化:
石蜡切片需用0.3%胰蛋白酶消化3~5分钟,然后用自来水冲洗、风干。
(6)孵育:
加一抗,37℃下孵育60分钟。
(7)洗涤:
用PBS(pH 7.4)洗掉抗血清后,用1%Triton X-100 PBS洗3次,每次5分钟,风干。
(8)再孵育:
用GAR IgG荧光孵育,37℃,30分钟,洗涤,脱盐,风干。
(9)封固:
风干后用甘油封固(pH 8.6,0.5mol/L,Na 2 CO 3 ∶纯甘油为1∶1)。
3.结果与评价
用荧光显微镜即可观察到组织细胞中的阳性荧光。在此实验中,非特异性荧光会直接影响结果的观察,应尽量避免。其有效方法是稀释抗血清并作脑粉吸附,稀释用0.3%的Triton X-100 PBS。再则,贴片时要尽量展平,以免空隙中存留血清产生非特异性荧光。另外,还需做对照试验。对照试验方法很多,常用的包括如下几种:
(1)标本自身荧光对照:
在标本上滴蒸馏水或PBS或甘油,不加任何血清,可产生自身荧光。
(2)对异对照:
直接在标本上加荧光抗体,不用一级抗体;或用同种动物的正常血清或制备抗体免疫注射动物前抽取的血清代替第一抗血清。
(3)阻断试验:
①一抗孵育标本,二抗用未标荧光素的GARIgG与荧光抗体的混合液代替荧光抗体孵育。GARIgG与荧光抗体之比10∶1~20∶1;②一抗血清孵育标本,再用未标荧光素的GARIgG孵育,浓度为荧光抗体的10~20倍洗涤,干燥后以荧光抗体做最后孵育。
(4)阴性对照:
用已知不存在相应抗原的组织,或与特异抗血清无交叉免疫反应的异种动物的组织标本染色,应为阴性。
(5)阳性对照:
用已知存在相应抗原的组织染色,应为阳性。
1.反应原理
该方法具体有三种:①酶标记抗体法;②免疫球蛋白-酶桥法;③可溶性酶-抗酶复合物法(PAP法)。临床上较常用的为PAP法,它分四步反应完成:
(1)一抗与组织中相应抗原特异性结合。
(2)二抗的一个Fab段与一抗的Fc段结合,另一个Fab段游离。
(3)兔PAP即过氧化物酶-兔抗过氧化物酶复合体与二抗中游离的Fab段结合。
(4)成色反应,即加过氧化氢和二氨基联苯胺,产生褐色沉淀。
2.方法与步骤
(1)包埋前染色:
1)固定:采用以下几种固定液:①0.1mol/L PBS缓冲的4%多聚甲醛溶液(pH 7.4);②0.1mol/L PBS缓冲的2%多聚甲醛+0.5%戊二醛溶液(pH 7.4);③改良的Bouin液(37%甲醛溶液250ml+饱和苦味酸溶液750ml)。
2)切片:Cryostat或Vibratome切成10~20pm切片,然后PBS洗涤3次。
3)1%H 2 O:甲醇处理:孵育10~20分钟,可阻断内源性过氧化物酶。
4)洗涤:0.2%Triton X-100 PBS溶液,室温下洗涤15分钟。
5)血清孵育:1∶20正常羊血清(PBS稀释的二抗正常血清)室温下孵育20分钟。
6)一抗用0.2%Triton X-100 PBS按1∶1000稀释的抗DBH血清,恒温37℃下60分钟,或温度4℃下过夜。
7)洗涤:PBS洗3次×3分钟。
8)二抗:0.025%Triton X-100 1∶10稀释的羊抗兔IgG,恒温37%下孵育60分钟。
9)兔PAP复合物(1∶50):室温孵育30分钟。
10)洗涤:PBS洗2次×3分钟。
11)显色:0.04%DAB+0.03%H 2 O 2 显色5~12分钟,充分洗涤。
12)光镜常规:苏木精衬染,盐酸乙醇分化,树胶封固,光镜观察。
13)电镜常规:在DAB显色反应后O s O 4 后固定60分钟,脱水、浸透、环氧树脂包埋、超薄切片、铀染色等。
(2)包埋后染色:
1)常规制样:灌流固定(勿用O s O 4 ),脱水树脂包埋,超薄切片。
2)捞片:用镍网捞片置于5%H 2 O 2 溶液中刻蚀3分钟。
3)羊血清:室温10分钟孵育。
4)一抗:(兔抗DpH血清1∶1000)室温孵育30分钟。
5)二抗:(羊抗兔IgG 1∶20)室温孵育30分钟。
6)兔PAP复合物(1∶20)室温孵育10分钟。
7)DAB-H 2 O 2 液显色2(含H 2 O 2 0.01%~0.03%)室温15分钟。
8)1%0 3 0固定15分钟,电镜观察。
3.结果与评价
反应产物呈茶褐色(光镜)、电子致密颗粒(电镜)。在DpH阳件的神经元包体中,DpH特异的免疫反应产物呈颗粒状,电子密度高,颗粒大小不均,粗糙不规则,这些颗粒在胞质中成串或成团聚焦。这些免疫反应沉淀物选择性地分布于高尔基复合体和滑面内质网及某些线粒膜的外表面,核与质膜上未见反应产物。
4.对照
①内源性HRP对照:实验标本不加抗体,孵育时只加双蒸馏水,洗涤显色与阳性标本相同。或仅以双蒸馏水取代PAP。②特异对照:未免疫豚血清代替豚抗DpH血清,或未免疫羊血清代替GARIgG。
(何小解)