




19世纪初,法国化学家盖-吕萨克在研究各种气体在化学反应中体积变化的关系时发现,参加同一反应的各种气体在同温、同压下,其体积成简单的整数比,而且气态反应物与产物的体积比也是简单的整数比,这就是气体反应体积简比定律。当时,盖-吕萨克十分赞赏道尔顿的原子论,于是很自然地将自己的化学实验结果与原子论相联系。他发现,原子论认为化学反应中各种原子以简单数目相结合的观点,可以通过自己的实验得到支持。盖-吕萨克也自认为自己的理论是对道尔顿原子论的支持和发展,并为之兴奋不已。
阿伏伽德罗Ⓟ
1809年,盖-吕萨克发表了他的气体反应体积简比定律。谁知道尔顿得知后,竟然立即公开表示反对。因为在道尔顿看来,不同元素的原子大小不会一样,其质量也不一样,因而相同体积的不同气体不可能含有相同数目的原子。而且,道尔顿认为,当氧气和氢气化合时,1体积氧气+2体积氢气=2体积水蒸气,而按照盖-吕萨克的气体反应体积简比定律,上式相当于:1个氧原子+2个氢原子=2个水原子;于是每个氧原子被分成了两半,分别进入一个“水原子”中。但原子不能再分,半个原子是不存在的,这是当时原子论的一个基本要点。为此,道尔顿坚决反对盖-吕萨克的假说。而盖-吕萨克认为自己的实验是精确的,不接受道尔顿的指责,于是双方展开了争论。
当道尔顿和盖-吕萨克因原子论和气体反应体积简比定律争论得不可开交的时候,1811年,意大利化学家阿伏伽德罗发现了矛盾的焦点,对盖-吕萨克的理论进行了修正,提出了阿伏伽德罗定律:“在同温、同压下,相同体积的不同气体具有相同数目的分子。”阿伏伽德罗在他的论文中声明自己的观点来源于盖-吕萨克的气体实验事实,与道尔顿体系具有一致性。接着,他明确地提出了“分子”的概念,认为单质或化合物在游离状态下能独立存在的最小质点为“分子”,单质分子可由多个原子组成。对此他解释说,之所以引进分子的概念是因为道尔顿的原子概念与实验事实发生了矛盾,必须用新的假说对原有的原子概念加以修正才能解决这一矛盾。分子学说恰好使道尔顿的原子论和气体反应体积简单比定律统一起来。但是分子学说当时并不为人接受,原因之一是它假设气体单质分子均为双原子分子,而这不具有普遍性。另外,当时取得辉煌电解实验成就的瑞典化学家贝采里乌斯提出了原子都带电、它们靠异性电荷相吸引而形成化合物的电化二元论,完美解释了电解现象,认为同种原子必然带有同种电荷,因此同种原子结合成分子是不可能的。
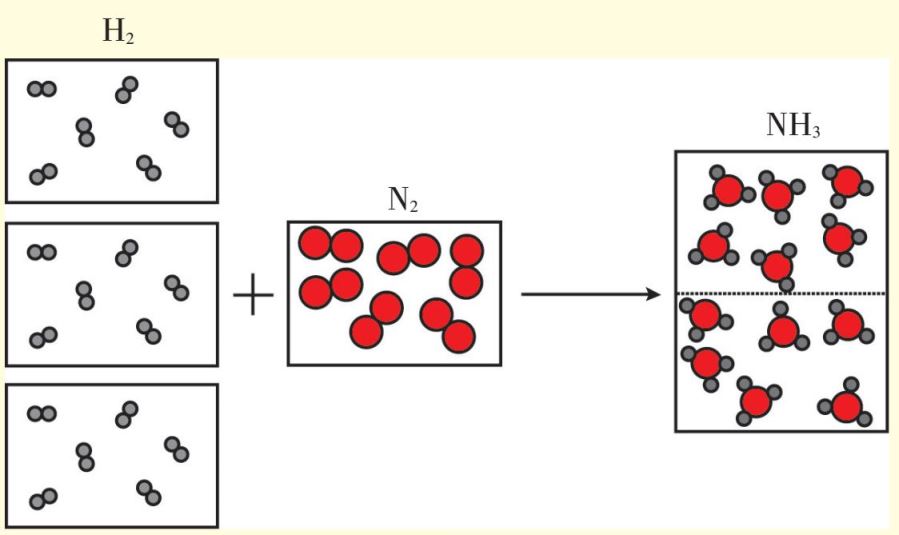
阿伏伽德罗定律表明,在同温、同压下,相同体积的不同气体
在原子论和分子学说提出后的50余年里,尽管很多元素的相对原子质量被准确测定,但仍有很多元素的相对原子质量没有能够被准确测定,而且几个相对原子质量体系共存,原子量(相对原子质量)、当量、化学式、分子式、分子量(相对分子质量)等基本概念搅成一团乱麻,造成了很大的混乱,甚至在1860年专门为此召开的国际化学大会上也没能形成统一的意见。在这关键时刻,意大利化学家坎尼扎罗撰写并散发了名为《化学哲学教程提要》的小册子,对有关工作做了客观公正的评述,对当时的争论点做了清晰的阐述,并在相对原子质量测量和计算等方面进行了重要修正和拓展,终于使分子学说得到公认,且被认为是整个化学的基础理论,对科学发展具有特别重大的意义。此时,阿伏伽德罗已经不在人世。为了纪念阿伏伽德罗的伟大功绩,1摩尔物质所含的结构粒子数目被命名为阿伏伽德罗常量。