





对锂盐的要求是:易溶于有机溶剂,易解离,锂离子具有高的淌度,阴离子具有高的氧化还原稳定性,与锂离子电池内部所有组件/相都能形成稳定的界面,阴离子无毒,对各种热诱导等副反应是稳定的,环保,成本低,水解稳定性高,不腐蚀铝箔。
多价阴离子锂盐可能是一种趋势,例如,一个负二价阴离子可以结合两个锂离子,有利于提高锂离子的淌度、锂离子扩散度。
锂盐组成通式为LiX,离解反应为
LiX↔Li + +X -
离解反应的动力是锂离子和阴离子的溶剂化,原则上希望阴离子X - 具有与溶剂很强的缔合作用,而Li + 的溶剂化程度低一些,这样既保证LiX的溶解又能保证大的Li + 迁移数,不过,事实正相反,X - 的溶剂化能力很低(这与其大的体积有关),而体积小的Li + 的溶剂化程度很高,导致锂盐的溶解度高但是锂离子迁移数比较低,一般在0.2~0.45范围,并且主要集中在0.25附近,在PC、EC、DMC和DME(二甲氧基乙烷,dimethyl ether,C 4 H 10 O 2 )中,NMR技术(核磁共振)测试的锂离子迁移数在0.35~0.50。
锂离子电池常用的锂盐是LiPF 6 ,此外还有一些锂盐的研究较多,包括LiClO 4 、LiAsF 6 、LiBF 4 、LiSO 3 CF 3 、LiN(SO 2 CF 3 ) 2 、LiC(SO 2 CF 3 ) 3 、LiPF 3 (C 2 F 5 ) 3 、LiBC 4 O 8 等。
高氯酸锂LiClO 4 的历史比较长,在一些一次锂电池中仍然得到应用,在20世纪70~80年代曾经广泛使用,但是和LiPF 6 比,它不能有效钝化铝箔,阴离子的氧化性比较强,具有潜在的爆炸危险。溶解后电导率很高,具有比较高的阳极氧化稳定性,价格低,与碳基负极材料兼容,产生的SEI层电阻低,耐湿气,缺点是其强的氧化性,和有机溶剂接触后易爆炸,在高温、大电流下与有机溶剂的反应活性明显增大。
LiAsF 6 ,与LiClO 4 类似,20世纪70~80年代得到广泛使用,特别有利于金属锂沉积/溶解效率,很多性能与LiPF 6 类似,在阳极上形成的SEI层十分稳定,具有出色的阳极与阴极电化学稳定性,2mol/L LiAsF 6 /MF(MF,甲酸甲酯)溶液电导率达到50mS/cm数量级,缺点是其As 5+ 容易被还原成剧毒低价氧化砷。与溶剂发生反应,以醚类为例,反应可以表示为
R
1
OR
2
+LiAsF
6
 LiF+O(AsF
5
)(R
1
)(R
2
)
LiF+O(AsF
5
)(R
1
)(R
2
)

AsF
5
+[O(R
1
)(R
2
)(AsF
4
)](AsF
6
)
[O(R
1
)(R
2
)(AsF
4
)](AsF
6
)可以进一步分解为CH
2
CH
2
,C
2
H
5
F,C
2
H
5
AsF
6
等;
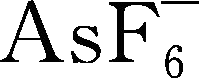 的还原电位为1.15V左右,反应为
的还原电位为1.15V左右,反应为
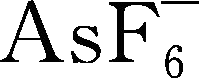 +2e↔AsF
3
+3F
-
+2e↔AsF
3
+3F
-
LiAsF 6 在以咪唑(imidazolium)为阳离子的离子液体中,石墨化碳电极上可稳定到5.05V,Pt上稳定到5.10V。
LiBF 4 (四氟硼酸锂)B—F键比P—F键稳定,所有锂盐中分子量最低的一个,293℃熔化并开始分解,不易水解,耐湿气,水汽含量可到620μg/g;热稳定性更好,毒性小于LiAsF 6 ,安全性高于LiClO 4 ,在低温和高温下稳定性好,具有中等水平的锂离子电导性,在PC和DMC中溶解度很高,溶解量在1mol/L以上,电化学窗口在3.5V左右,1mol/L LiBF 4 /PC的电导率为3.4mS/cm,1mol/L LiBF 4 /EC+DMC的电导率为4.9mS/cm,容易使铝箔钝化,尤其是更高的电位下,因此,使用该盐的电解液显示更高的循环稳定性(无论是升高温度或者降低温度的前提下);配成的溶液黏度小,适合低温应用;作为添加剂使用时可改进低温以及高温循环稳定性;和LiPF 6 相比化学稳定性略差。可用碳酸锂和三氟化硼合成,反应为
3Li
2
CO
3
+9BF
3
 6LiBF
4
+3CO
2
+(BOF)
3
6LiBF
4
+3CO
2
+(BOF)
3
反应温度为300℃。另一个合成路径为
4HF+H
3
BO
3
 HBF
4
+3H
2
O
HBF
4
+3H
2
O
2HBF
4
+Li
2
CO
3
 2LiBF
4
+H
2
O+CO
2
2LiBF
4
+H
2
O+CO
2
后一个步骤更加环保。四氟硼酸锂是白色晶体粉末,最大的缺点是电化学窗口太小了,在石墨碳负极表面不能形成稳定的SEI结构。
和碳负极表面形成的SEI的稳定性,目前存在争论,有文献认为其破坏SEI的稳定性从而降低负极的循环寿命;还有文献认为它和碳负极形成的SEI薄膜电阻更小。与该锂盐比较匹配的溶剂是γ-丁内酯,该溶剂和LiPF 6 不兼容。
LiB(CN) 4 (四氰基硼酸锂)可以认为是LiBF 4 的衍生物,F为CN基团所取代,相对分子质量为122,合成反应为
4SiMe
3
CN+LiBF
4
 LiB(CN)
4
+4SiMe
3
F
LiB(CN)
4
+4SiMe
3
F
反应在低温、有机溶剂中进行。另一个合成路径是
AgB(CN)
4
+LiCl
 LiB(CN)
4
+AgCl
LiB(CN)
4
+AgCl
LiB(CN)
4
的分解温度为500℃。晶体结构中,每个Li被四个N包围,每个B被四个C包围,形成LiN
4
和BC
4
四面体。氰基的强吸电子效应赋予
 阴离子很强的抗氧化能力,电化学窗口上限为5.5V,阴离子基团上电子强的非局域化特征使锂离子的离解能很低(该阴离子与锂离子的亲和力小于
阴离子很强的抗氧化能力,电化学窗口上限为5.5V,阴离子基团上电子强的非局域化特征使锂离子的离解能很低(该阴离子与锂离子的亲和力小于
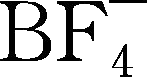 、
、
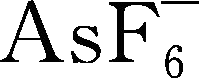 和
和
 ),离子导电能力高。从电化学稳定性和离子导电性来看,它适合作为锂离子电池电解液的锂盐。缺点有两点,一是循环中它会逐渐衰减,二是会生成剧毒氰化物。
),离子导电能力高。从电化学稳定性和离子导电性来看,它适合作为锂离子电池电解液的锂盐。缺点有两点,一是循环中它会逐渐衰减,二是会生成剧毒氰化物。
LiBOB相对分子质量为194,分解温度为302℃,DME中最大溶解度为1.6mol/L,导电率为9mS/cm,在EC+DMC中最大溶解度为0.8mol/L,导电率为7.5mS/cm。水溶液的合成过程会含有水杂质,不符合锂离子电池使用,非水溶液中的合成工艺为
LiOH+2H
2
C
2
O
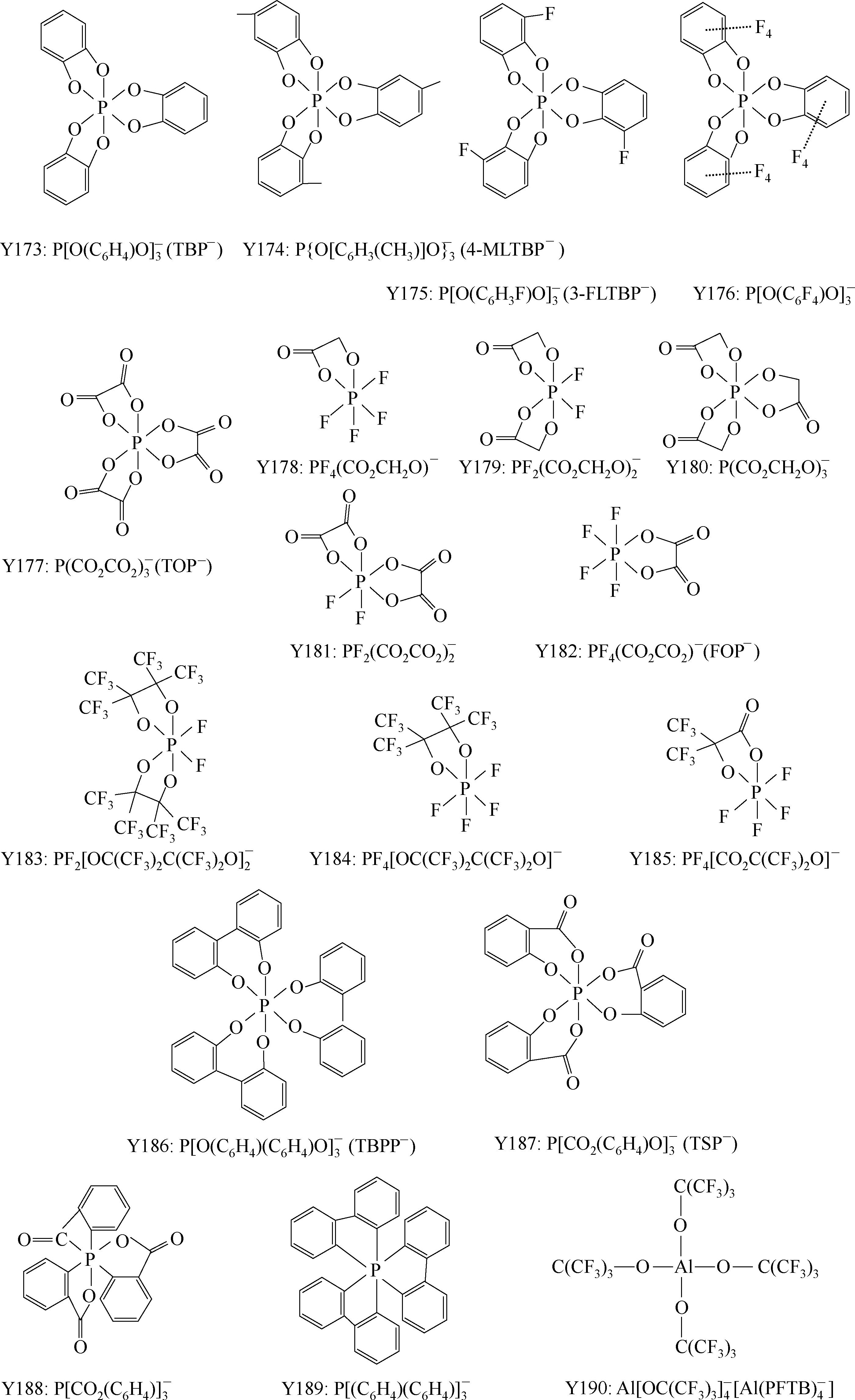
4
+H
3
BO
3
 LiB[(OCO)
2
]
2
+4H
2
O
LiB[(OCO)
2
]
2
+4H
2
O
LiB(OCH
3
)
4
+2(CH
3
)
3
SiOOCCOOSi(CH
3
)
3
 LiB[(OCO)
2
]
2
+4CH
3
OSi(CH
3
)
3
LiB[(OCO)
2
]
2
+4CH
3
OSi(CH
3
)
3
LiBOB在有机溶剂中很稳定,不与溶剂发生反应,在PC中电化学窗口上限为4.5V,但是在1.75V发生还原分解,在石墨表面形成完整稳定的SEI界面,阻止PC分子共嵌入,因此,可以作为添加剂使用修饰负极表面SEI层。可以使铝箔钝化。与PC匹配可以使磷酸铁锂在120℃高温下稳定运行。0.7mol/L LiBOB/EC+PC+DMC,在55℃运行下显示比经典电解液体系循环稳定性更好,因此,它还可以作为高温性能改进的添加剂使用。LiBOB/GBL+SL+DMC是可以与高压尖晶石正极匹配的电解液体系,安全运行在4.8V。GBL是γ-丁内酯,SL为环丁砜,DMC的作用是降低电解液的黏度。LiBOB/TEGDME(1∶4质量比)电解液体系,价格低,更安全,电导率在1~10mS/cm,可以稳定到180℃。TEGDME全称为tetraethylene glycol dimethylether。该体系稳定到4.6V,在1.5V发生BOB阴离子还原分解。
LiBOB还适合Si负极和离子液体,在于Si负极匹配时SEI层中存在Li x BO y ;和它匹配的离子液体是1-乙基-3-甲基咪唑,简称EMIBF 4 ,阴离子的中文名称为四氟硼酸阴离子。LiBOB可以抑制锂金属和EMI + 。
LiBOB可以捕捉六氟磷酸锂分解产物HF和PF 5 ,这点使得它可以作为含锰正极的添加剂,减弱六氟磷酸锂对正极的危害;还可以提高电池的耐过充能力,过充条件下LiBOB会发生分解生成LiBO 2 和CO 2 。在经典电解液中适量添加可以改进LiCoPO 4 的循环稳定性;还广泛应用于凝胶和固体聚合物电解质体系中。例如,无溶剂锂离子导体聚合物PEO-LiBOB体系,在30~80℃范围离子电导率为10 -5 ~10 -3 S/cm。还可以和PEOEMA[poly(2-ethoxyethyl methacrylate)]、PMMA等构成凝胶电解质体系。
缺点是LiBOB含量太高时会增大负极表面SEI层的厚度,界面阻抗增大明显。
LiDFOB分解温度240℃,碳酸酯类溶剂中溶解度大于LiBOB,在EC+DMC中最大溶解度为1.2mol/L。合成路线为
3H
2
C
2
O
4
+2H
3
BO
3
 B
2
(C
2
O
4
)
3
B
2
(C
2
O
4
)
3
B
2
(C
2
O
4
)
3
+4LiF
 2LiDFOB+Li
2
C
2
O
4
2LiDFOB+Li
2
C
2
O
4
产物使用乙腈和甲苯重结晶后即可得到高纯LiDFOB;另一个合成反应为
Li
2
C
2
O
4
+BF
3
O(C
2
H
5
)
2
 O(C
2
H
5
)
2
+LiF+LiDFOB
O(C
2
H
5
)
2
+LiF+LiDFOB
在240℃开始分解,在PC+EC+DMC溶剂中在温度低于-30℃时,LiDFOB的导电率高于LiBOB,1mol/L LiDFOB/EC+PC+DMC(体积比1∶1∶3)电导率在25℃为8.25mS/cm,适合低温应用,可以使铝箔钝化,人工石墨负极表面形成的SEI阻抗低,通过一系列交换反应使SEI得以稳定,反应机理
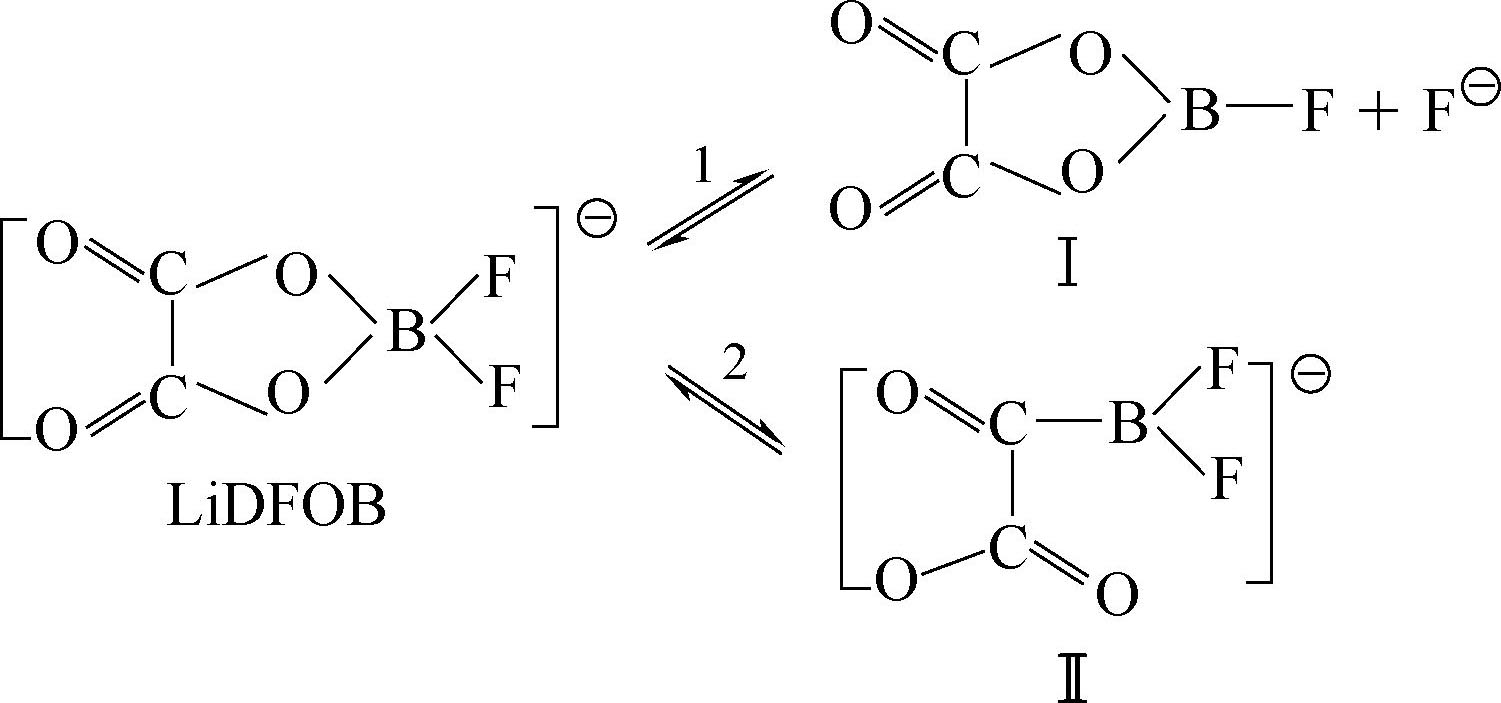
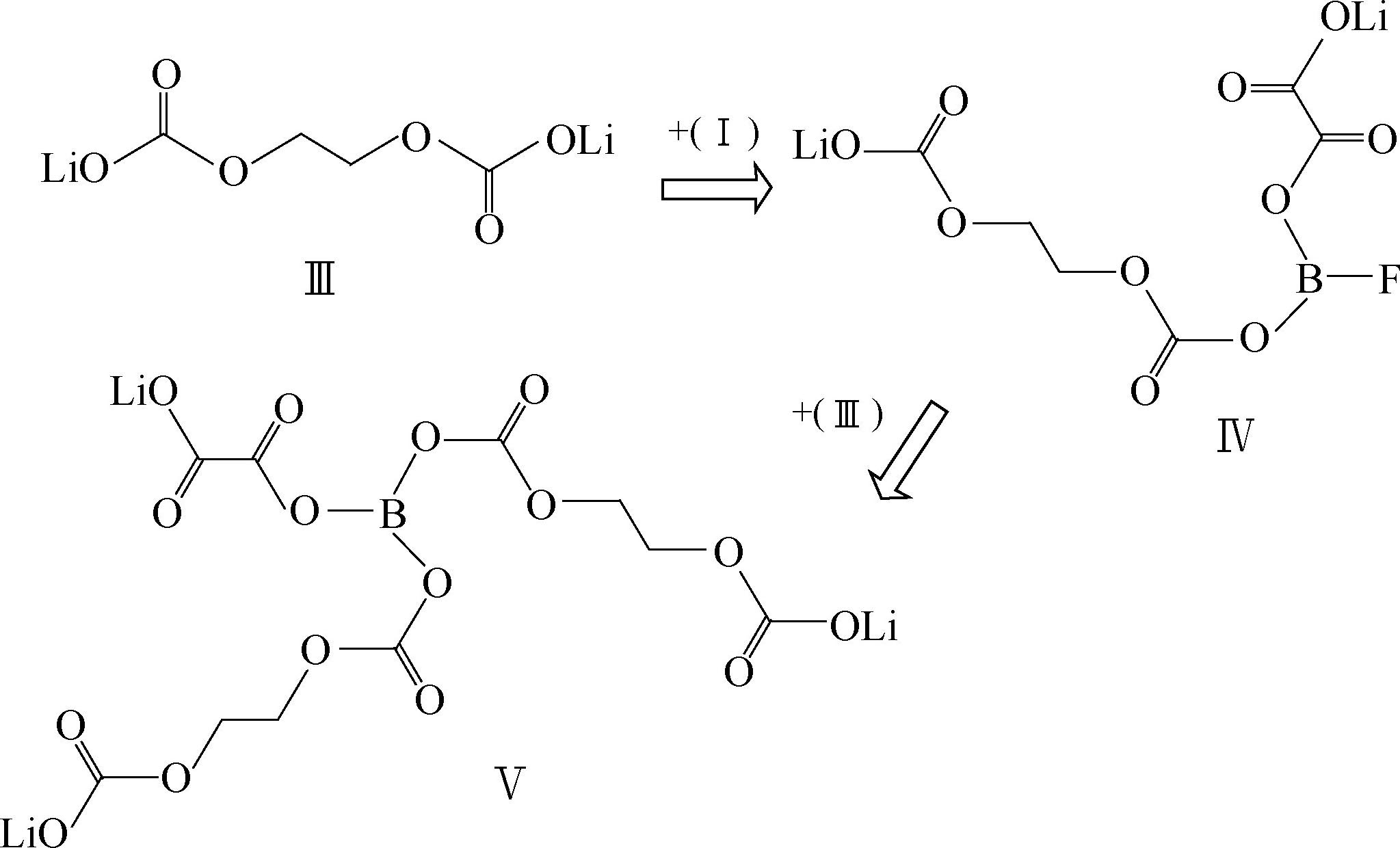
其中物质Ⅰ和Ⅱ可以和SEI的主要成分比如Ⅲ反应生成更加稳定的SEI成分。LiDFOB可以增强热稳定性,改进高温循环稳定性,但是研究得还不够透彻,数据不是很多。
LiBBB,英文全称为lithium bis[1,2-benzenediolato(2-)- O , O ']borate,分解温度250℃,PC中最大溶解度1.1mol/L,合成反应为
LiOH+B(OH)
3
+2C
6
H
4
(OH)
2
 LiB(C
6
H
4
O
2
)
2
LiB(C
6
H
4
O
2
)
2
250℃开始分解,大的苯环上电荷的非局域化作用抑制了离子对形成,这一点对离子电导是有利的。电化学窗口小于LiPF 6 ,大约为3.6V,氟化处理可以提高其电化学窗口,例如LiBFBB,英文全称为lithium bis[3-fluoro-1,2-benzenediolato(2-)- O , O ']borate,可以稳定到3.75V,合成反应为
LiOH+B(OH)
3
+2C
6
H
3
F(OH)
2
 LiB(C
6
H
3
FO
2
)
2
LiB(C
6
H
3
FO
2
)
2
LiBTBB,英文全称为lithium bis[tetrafluoro-1,2-benzenediolato(2-)- O , O ']borate,270℃开始分解,在碳酸酯溶剂中溶解度很小,但是,强的吸电子取代基团的存在引起的阴离子中电荷的非局域化作用,使其阴离子和溶剂的作用很弱,这也导致了足够高的离子导电能力。电化学稳定窗口上限为4.1V。该物质的合成反应为
C
6
H
5
OK+C
2
H
4
O
 C
8
H
4
F
4
O
2
+KF
C
8
H
4
F
4
O
2
+KF
LiB(OCH
3
)
4
+2C
8
H
4
F
4
O
2
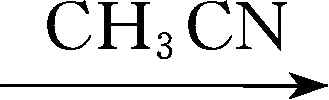 LiBTBB+4CH
3
OH
LiBTBB+4CH
3
OH
LiBNB,英文全称为lithium bis[2,2'-naphthalenediolato(2-)- O , O ']borate,320℃开始分解,在碳酸酯溶剂中的溶解度比较低,合成反应为
2C
10
H
8
O
2
+B(OH)
3
+LiOH
 Li[B(O
2
C
10
H
6
)
2
]+4H
2
O
Li[B(O
2
C
10
H
6
)
2
]+4H
2
O
使用LiBNB的电解液的黏度明显大于LiBBB的,但是导电能和LiBBB的接近,电化学窗口为3.8V。
LiBSB,英文全称为lithium bis (salicylate-2-)borate,有两个salicylato络合基团,290℃开始分解,碳酸酯溶剂中最大溶解度为1.3mol/L,合成反应为
LiOH+B(OH)
3
+2C
7
H
6
O
3
 LiB(C
7
H
4
O
3
)
2
+4H
2
O
LiB(C
7
H
4
O
3
)
2
+4H
2
O
该锂盐电解液的电导率低于使用LiBBB的,库仑效率高于LiBBB,可能适合于低压锂离子电池。
LiBBPB,英文全称为lithium bis[2,2'-biphenyldiolato(2-)- O , O ']borate,370℃开始分解,更好的热稳定性源自于双酚基团共轭能高于苯和萘。碳酸酯溶剂中溶解度很低,电导率很低。合成反应为
LiB(OCH
3
)
4
+2C
12
H
8
(OH)
2
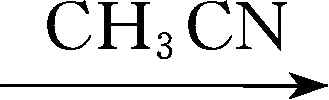 LiBBPB+4CH
3
OH
LiBBPB+4CH
3
OH
电化学稳定窗口为4.1V。
LiBDOB,英文全称为lithium[1,2-benzenediolato(2-)- O , O ' oxalato]borate,256℃分解,在碳酸酯类溶剂中溶解度远低于LiBBB,合成反应为
C
2
H
2
O
4
+C
6
H
6
O
2
+H
3
BO
3
+
 Li
2
CO
3
Li
2
CO
3
 LiBDOB+
LiBDOB+
 H
2
O+
H
2
O+
 CO
2
CO
2
其非对称的结构使其电解液具有比LiBBB高的离子导电能力。
LiSOB(lithium salicylato-oxalato borate),合成反应为
C
2
H
2
O
4
+C
7
H
6
O
3
+H
3
BO
3
+LiOH
 LiSOB+4H
2
O
LiSOB+4H
2
O
或者
C
2
H
2
O
4
+C
7
H
6
O
3
+H
3
BO
3
+
 Li
2
CO
3
Li
2
CO
3
 LiSOB+
LiSOB+
 H
2
O+
H
2
O+
 CO
2
CO
2
一般作为添加剂使用,1.6V和1.02V还原分解,4.51V上限。
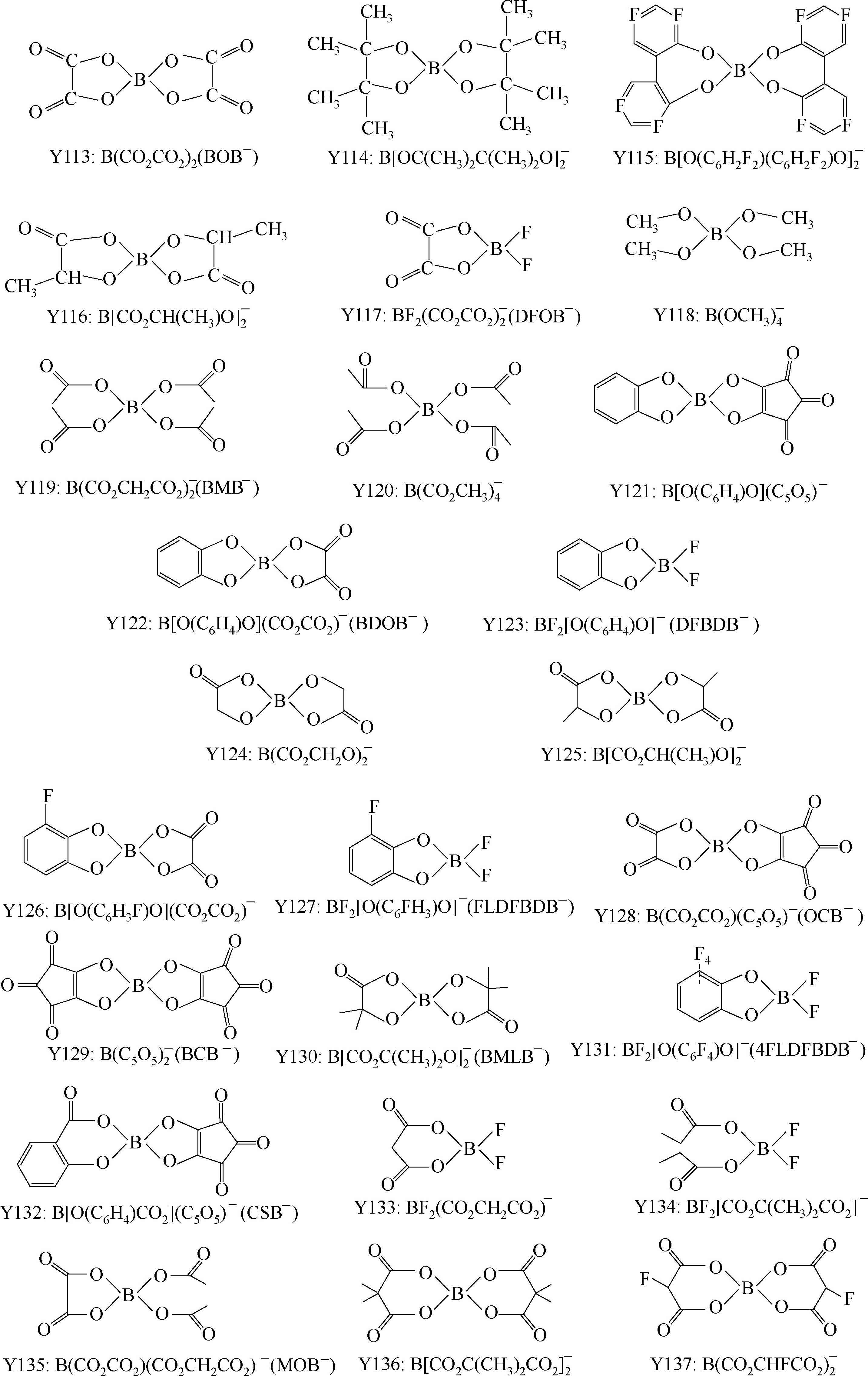
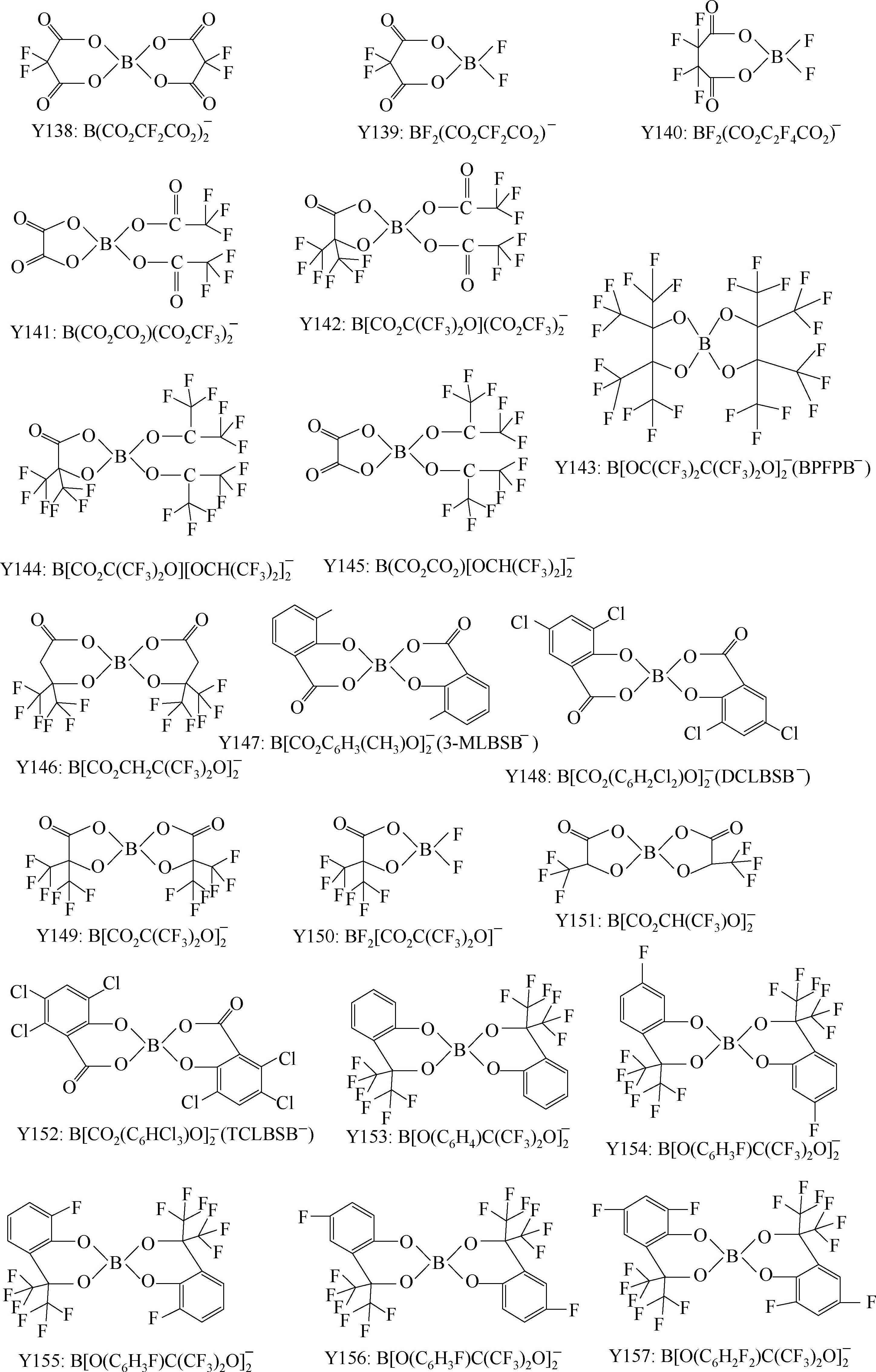
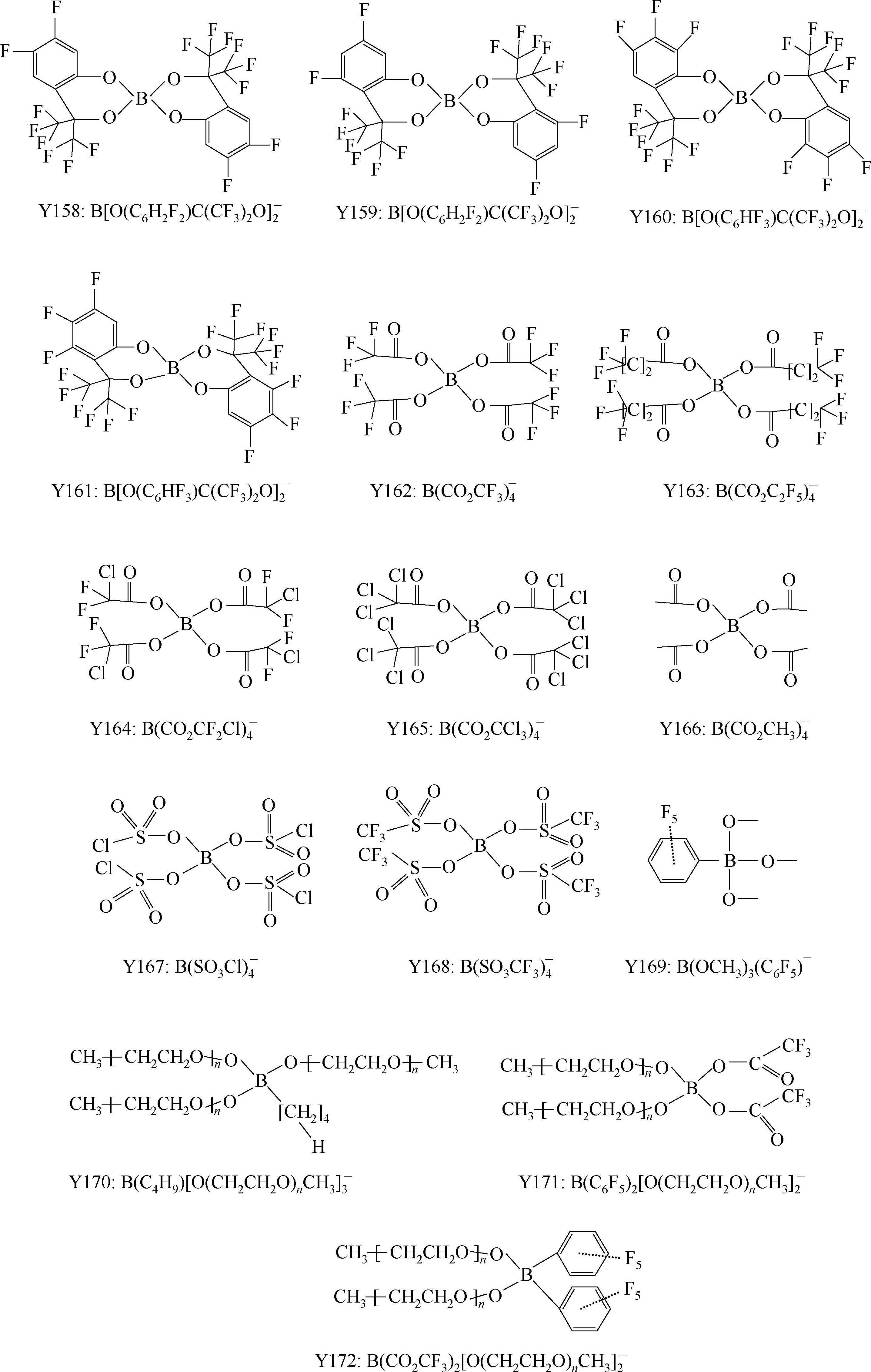
有机含硼阴离子的特点是稳定性好、溶解度高,电化学窗口与常见的标准电解液差不多,热分解温度一般高于250℃,分成芳香基含硼阴离子和烷基含硼阴离子,烷基类的热稳定性低于芳香基的;取代基团性质对溶解性及电导率影响明显,如EC+DMC中TCLBSB的溶解度小于DCLBSB,二者的差别仅仅在苯环上差一个Cl原子,二者结构见Y148和Y152。
LiBOB与正极和负极都兼容,但是与带电正极的兼容性不如LiPF 6 。从导电率来看,LBBB、LBNB、LBSB和3-MLBSB在EC+DMC中的电导率大约为2~5mS/cm。1mol/L LiBOB/DME的电导率在25℃为14.9mS/cm,电化学窗口为4.5V。用更大的取代基团替代LiBF 4 中的F,可以明显提高导电性,例如,EC+EMC(1∶3,体积比)中,浓度均为1mol/L的前提下,在20℃,LiBF 4 的电导率为2.91mS/cm,一个CF 3 基团取代后电导率增大到3.21mS/cm,更大的C 2 F 5 基团取代则增大到3.31mS/cm,一个SO 2 CF 3 基团取代后增大到4.47mS/cm,取代基团数量增多,会进一步提高导电性,如四个F全被SO 2 CF 3 取代,电导率提高到8.55mS/cm。
无氟的有机硼酸盐阴离子的优点很明显,不会引入HF中间杂质;阴离子结构中多个强吸电子中心的存在(B和O)使得负电荷广泛分布于阴离子集团上,负电荷分布分散,这降低了阴离子和锂离子的作用,赋予该类盐高的解离能力,溶解度也就高。
这类锂盐的一个缺点是吸湿性强。
LiTf,英文全称为lithium trifluoromethanesulfonate,抗氧化能力强,热稳定性好,无毒,空气中稳定,与碳纤维配对时,性能超过LiPF 6 ,锂离子导电性差,形成厚的高阻SEI薄膜,对Al腐蚀严重。
LiIm,英文全称为lithium bis(trifluoromethanesulfonyl)imide,安全性好,热稳定,高导电性,对Al集流体腐蚀严重。无溶剂离子液体中,石墨化碳电极电极上稳定到5.06V,Pt电极上稳定到5.13V。
LiSO 3 CF 3 ,三氟甲基磺酸锂,与LiPF 6 的电化学接近,抗氧化,溶解于EC后库仑效率比较高,缺点是电导率低,25℃溶解于PC中电导率为1.7mS/cm,原因是形成溶液中离子对;其阴离子与Al作用强烈,导致2.7V时铝箔就开始溶解;一般用作聚合物电解质的锂盐,不易水解,热稳定性好,导电性差,高电位下腐蚀铝箔,还没有商业化。克服其缺点的一种办法是开发LiSO 3 C n F 2 n +1 ( n >1)系列盐,它在溶剂或聚合物中容易离子化以提供更好的离子导电性,具有更高的电化学稳定性,与Al箔的兼容性也得到提高。
LiN(SO 2 CF 3 ) 2 ,简写为LiTSFI,存在两种构型,强的吸电子基团氯离子和磺酸基团引起的共振结构引起了通过阴离子的—SO 2 —N—SO 2 —骨架的负电荷的去局域化,阴离子多余的负电荷比较分散,与锂离子作用的是氧而不是其他负电荷的元素,制备的电解液导电性略差于但是接近LiPF 6 ,热稳定性好,因为C—F键的稳定性,所以不易水解,但是浓度比较低的时候对铝箔腐蚀性很强,浓度很高的时候腐蚀性要弱得多。在360℃分解,氧化电位上限为5.0V,与Al箔兼容性差,大约在4.0V开始发生腐蚀。离子液体中使用该盐时不会腐蚀铝箔。该盐的腐蚀性和浓度以及溶剂有关系。LiTFSI性能研究比较透,可能适合锂离子电池体系,它可以明显改进固体聚合物电解质的导电性。
LiC(SO 2 CF 3 ) 3 溶解能力强,电导率高,甚至高于LiPF 6 ,在温度低于-20℃时,LiAsF 6 和LiTFSI的电导率迅速降低,但是LiC(SO 2 CF 3 ) 3 的电导率仍然有1mS/cm以上,缺点是在4.5V以上时开始腐蚀正极集流体Al;和其结构类似的是LiCH(SO 2 CF 3 ) 2 ,不过其电化学窗口比较小。实际应用可能性比较大的是LiPF 3 (C 2 F 5 ) 3 和LiBC 4 O 8 (LiBOB),后者可使Al集流体稳定到5.0V以上。
某种锂盐与Al兼容性差时解决途径包括:加入钝化剂(可以是其他锂盐或者溶剂,如LiBF 4 );引入长链烷烃或者氟化烷烃官能团。当然,可以换个角度思考,在开发各种类型的锂盐同时,也可考虑开发新的集流体材料以适应锂盐。事实上,锂离子电池中每种部件或者材料或者添加剂是否能使用,除了自身的本征特征,很大程度上还取决于其他部件/材料/组分的选择。需要考虑相互之间的耦合因素,某一成分/相不适合于某一体系不等于它也不适合其他体系。
图1-11为其他一些常见锂盐的电化学窗口,包括各种锂盐的稳定电位范围,各种界面的可能反应倾向、锂盐的可能应用范围等。
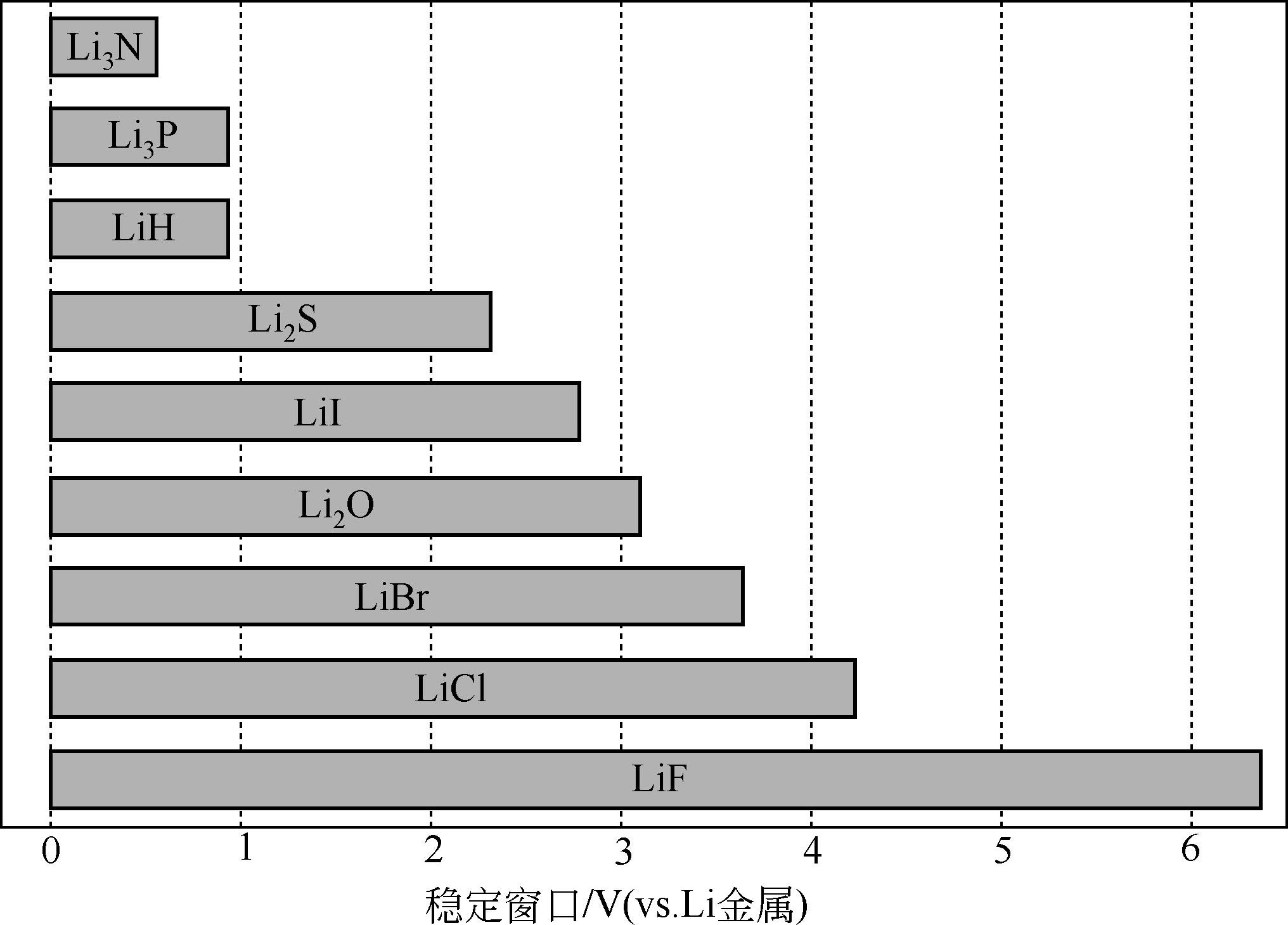
图1-11 一些典型锂盐电化学稳定窗口
简单总结为:LiAsF 6 有毒,LiClO 4 有爆炸性,LiBF 4 对碳阳极有害(还存在争论)且有毒,LiSO 3 CF 3 溶液电导率太低,LiN(SO 2 CF 3 ) 2 和LiC(SO 2 CF 3 ) 3 腐蚀正极集流体金属铝,LiPF 6 分解成HF和PF 5 ,PF 5 与水反应生成HF和POF 3 。
目前使用最多的是LiPF 6 盐,在实验室研究中也有使用LiClO 4 盐。LiPF 6 ,白色晶体,175~185℃分解,可溶解于醚、腈、吡啶、醇、酮、酯类等,不溶于烷烃、苯等,一般,溶剂极性越强溶解度越高。
LiPF 6 的最大缺点是稳定性还不完美,在有机溶剂中存在分解平衡,即
LiPF
6
 LiF+PF
5
LiF+PF
5
产物中的LiF会干扰负极表面SEI层,而产物PF 5 具有很强的Lewis酸性,可与溶剂上的孤对电子作用,催化溶剂分解、聚合,如
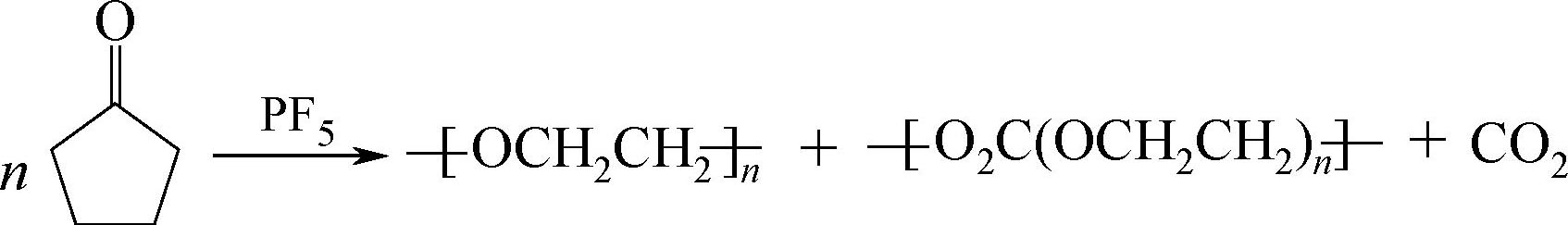
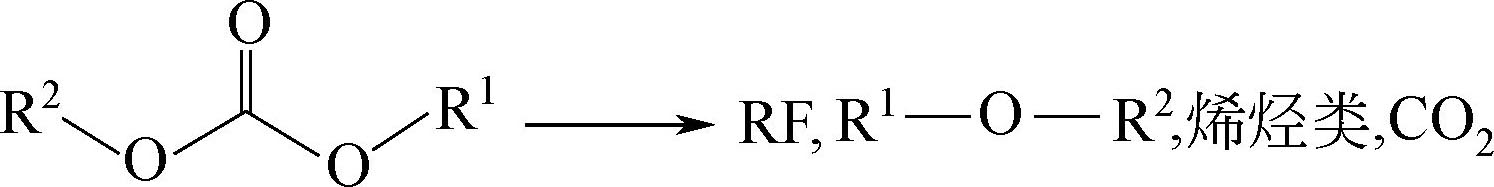
PF 5 还会和痕量的水反应生成酸,即
H
2
O+PF
5
 HF+POF
3
HF+POF
3
生成的HF又会和正极反应,引起正极性能衰减。使用PC作为溶剂时,LiPF 6 和PC可能会发生反应
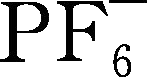 +PC
+PC
 PF
5
+e+HF+•{O
PF
5
+e+HF+•{O
 C[OC(CH
3
)CH
2
O]}
C[OC(CH
3
)CH
2
O]}
LiPF 6 的溶解度和导电性都高,和Al箔兼容,形成稳定的惰性界面,和碳阳极兼容,各方面性能兼顾得比较好。缺点是P—F键不稳定,易水解,HF的存在也是它的一个弱点;高纯产品生产较难。
尽管有上述缺点,LiPF 6 仍然得到实际应用,它各方面的性能比较综合,是唯一商业化的锂盐,对湿气、溶剂都比较敏感,高温下的热稳定性差,制备、提纯难度很大。20℃时1mol/L LiPF 6 /EC+DMC的电导率大约可以达到10mS/cm数量级,氧化电位上限在5.1V以上,与正极铝箔基体兼容,可以使铝箔钝化。在咪唑阳离子离子液体中,LiPF 6 的上限电位,GC(石墨化碳电极)上为4.94V,Pt上为5.0V。
六氟磷酸锂的纯度明显影响SEI的形成,高纯LiPF 6 是开发功能电解液的关键,在1994年,高纯生产工艺得到实用化。高纯与普通产品的SEM图中颗粒形貌有一些差别,如图1-12所示,高纯产品结晶更加完美,单晶颗粒尺寸更大,形状更加规则。

图1-12 经典(a)和高纯(b)六氟磷酸锂的SEM图
使用普通的和高纯的LiPF 6 ,配成电解液与石墨负极放置5天后测量的HF含量变化,如图1-13所示,普通的达到62μg/kg,对于高纯的,5天后稳定在21μg/kg。
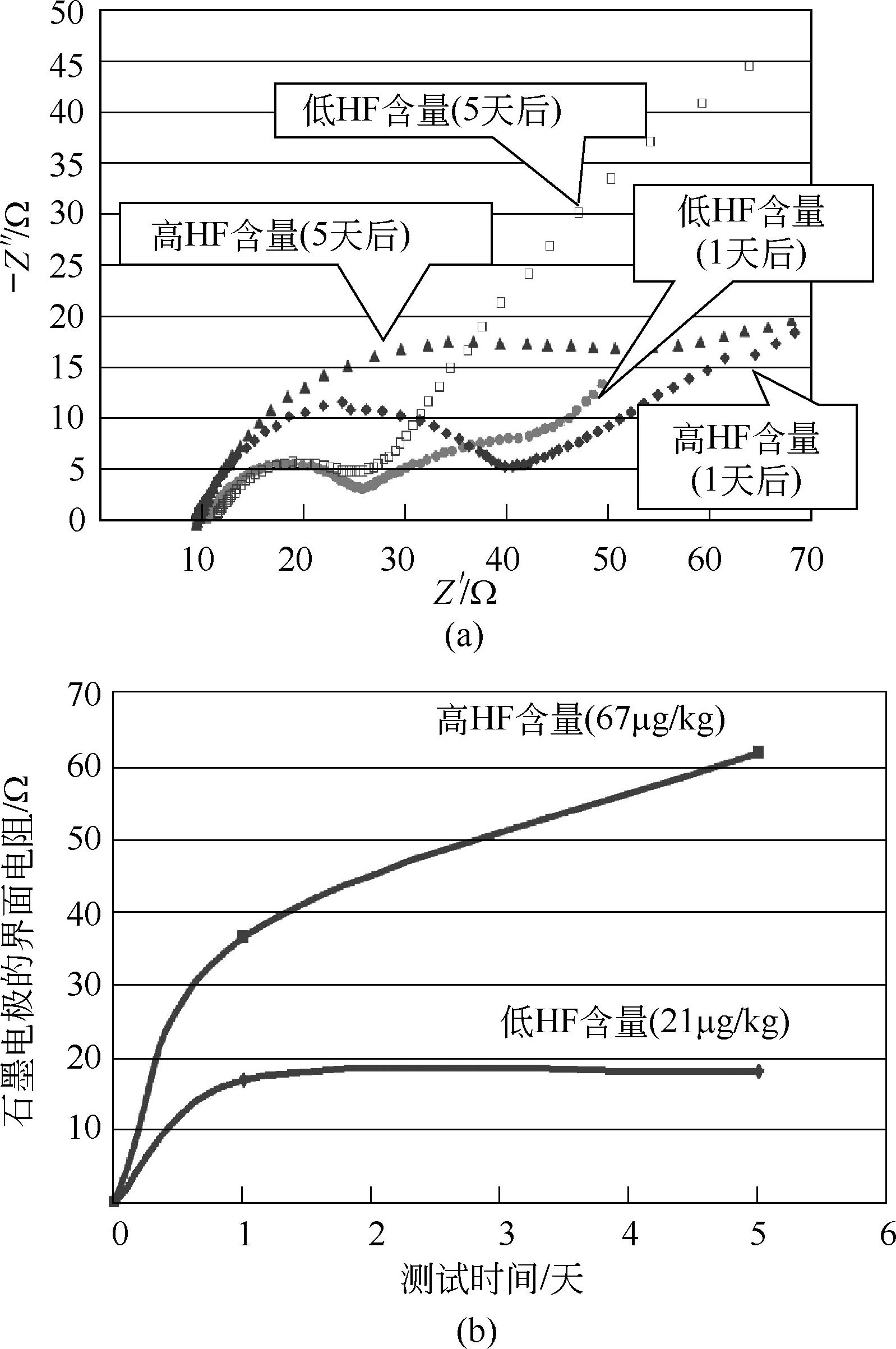
图1-13 电解液中HF含量对石墨电极阻抗的影响(a)及HF稳定含量与LiPF 6 纯度的关系(b)
离子的淌度,一定程度上反映了溶液中锂离子的运动能力,淌度高有利于液相锂离子的传输。根据文献总结,常见锂盐中离子淌度从大到小的顺序是LiBF 4 >LiClO 4 >LiPF 6 >LiAsF 6 >LiTf>LiIm。
锂盐的离解能力决定了锂盐的溶解度。一般,极性强的溶剂中离解能力要高,此外,锂盐自身的锂离子和阴离子的作用力也决定了其溶解(解离)能力。常见锂盐的离解常数顺序是LiTf<LiBF 4 <LiClO 4 <LiPF 6 <LiAsF 6 <LiIm。
锂盐的电化学稳定窗口是另一个重要的参数,其氧化、还原稳定性主要由阴离子决定,有文献认为,锂盐阴离子氧化稳定性顺序为
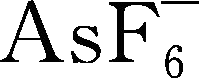 gt
gt
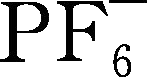 gt
gt
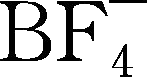 gt;TFSM
-
>TFSI
-
>
gt;TFSM
-
>TFSI
-
>
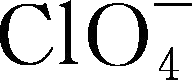 gt
gt
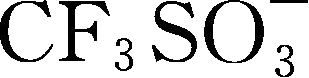 gt
gt
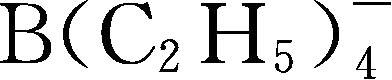 ,其中关于
,其中关于
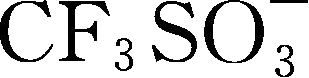 的稳定上限存在5.1V和6.0V两种说法。
的稳定上限存在5.1V和6.0V两种说法。
盐的稳定性实际上也是相对的,很多盐都可以发生分解反应、氧化反应,例如
LiClO
4
+e+Li
+
 Li
2
O+LiClO
3
,LiClO
2
+LiCl
Li
2
O+LiClO
3
,LiClO
2
+LiCl
LiAsF
6
+2e+2Li
+
 AsF
3
+3LiF
AsF
3
+3LiF
AsF
3
+2
n
e+2
n
Li
+
 Li
n
AsF
3-
n
+
n
Li
+
+
n
F
-
Li
n
AsF
3-
n
+
n
Li
+
+
n
F
-
LiPF 6 ↔LiF+PF 5
PF
5
+H
2
O
 2HF+POF
3
2HF+POF
3
PF
5
+2
n
e+2
n
Li
+
 LiPF
6-
n
+
n
LiF
LiPF
6-
n
+
n
LiF
LiPF
6
+2e+2Li
+
 PF
3
+3LiF
PF
3
+3LiF
一些杂质参与的反应包括
H
2
O+e+Li
+
 LiOH+H
2
LiOH+H
2
2CO
2
+2e+2Li
+
 Li
2
CO
3
+CO
Li
2
CO
3
+CO
O
2
+4e+4Li
+
 2Li
2
O
2Li
2
O
一些副反应包括
LiMF
n
+H
2
O
 LiM
x
O
y
+
n
HF+MO
x
F(M=P,B;
n
=4,6)
LiM
x
O
y
+
n
HF+MO
x
F(M=P,B;
n
=4,6)
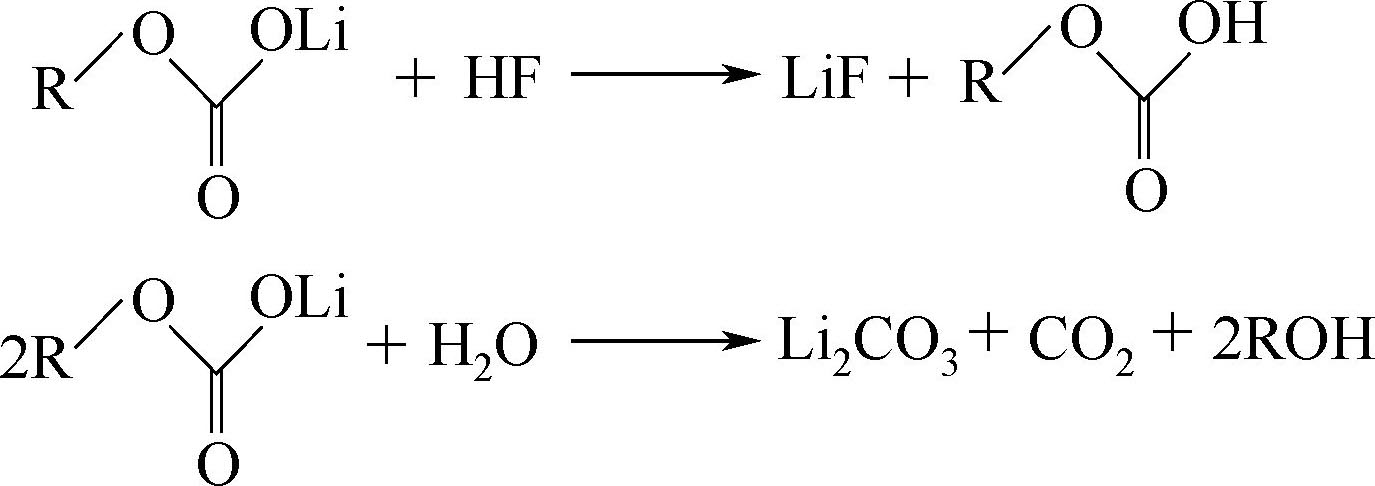
2CO
2
+2e+2Li
+
 Li
2
CO
3
+CO
Li
2
CO
3
+CO
Li
2
CO
3
+2HF
 2LiF+CO
2
+H
2
O
2LiF+CO
2
+H
2
O
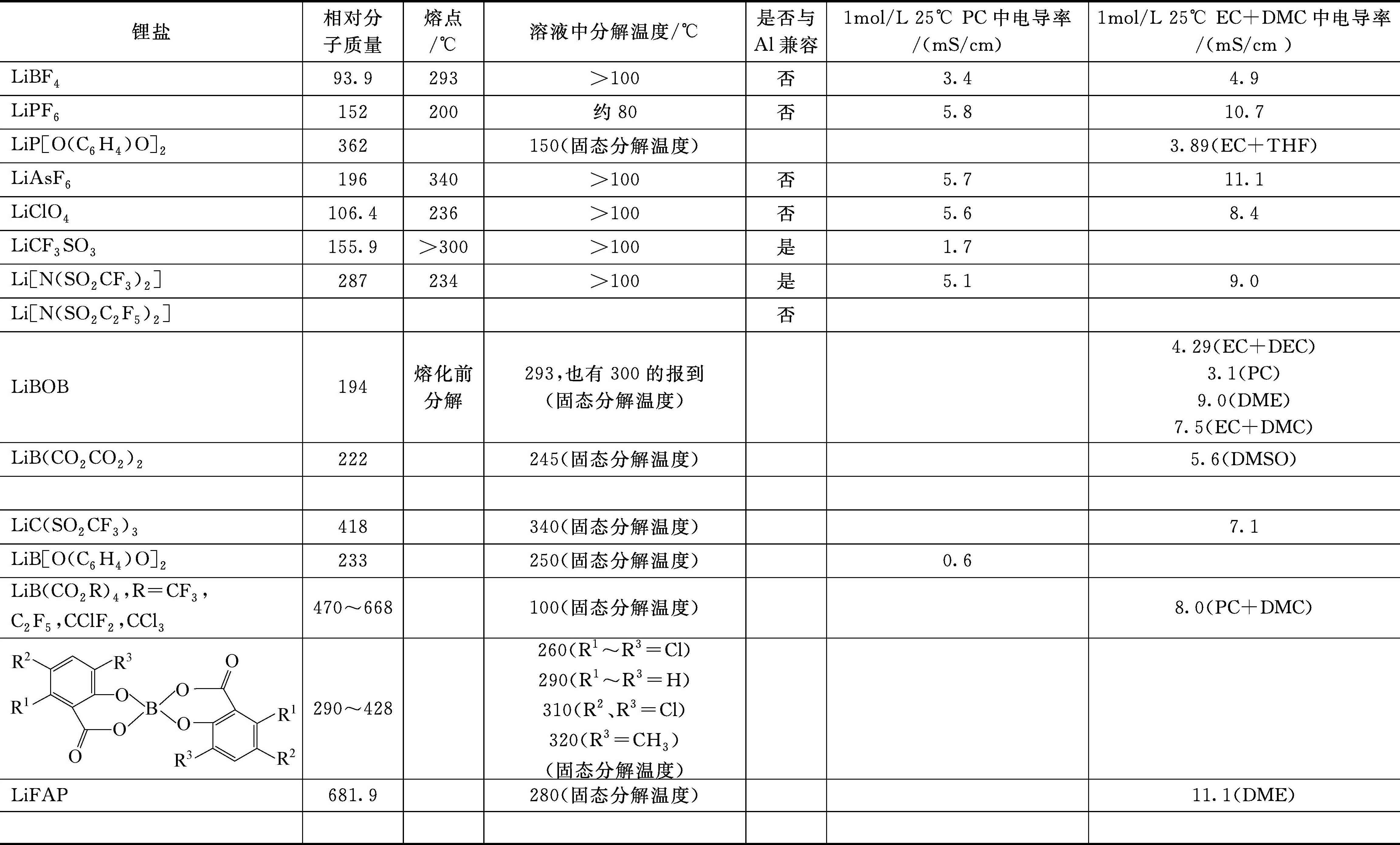
表1-2是总结的一些锂盐的理化参数。
表1-2 锂盐特性
锂盐在锂电中作为溶质使用时的研究内容,包括合成工艺、提纯方法,溶解度和解离特性,氧化还原稳定性,潮解特性,配成溶液后的电化学与化学窗口等。作为电化学应用时,主要测试分析手段,如前所述。
下面主要介绍常见的阴离子。
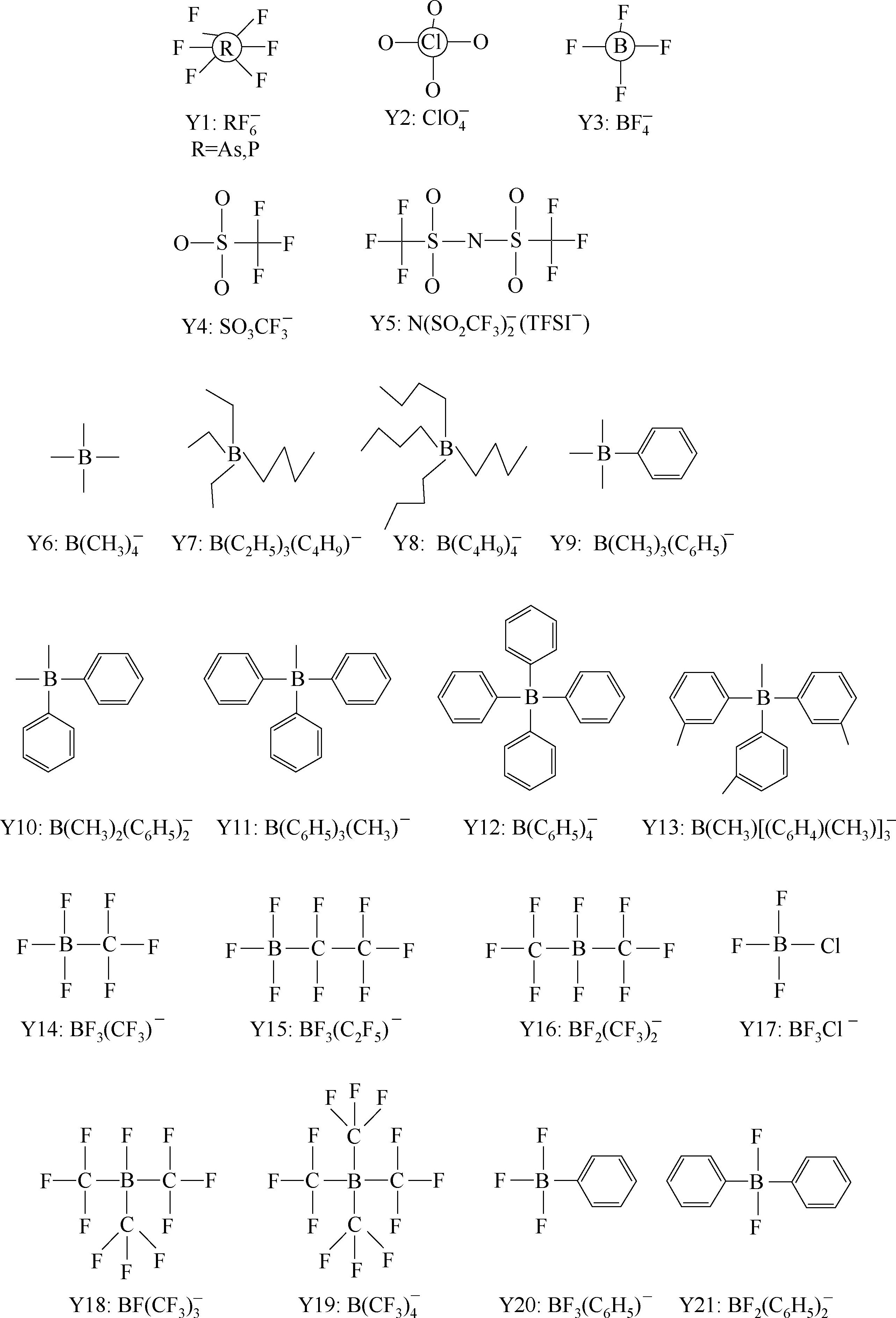
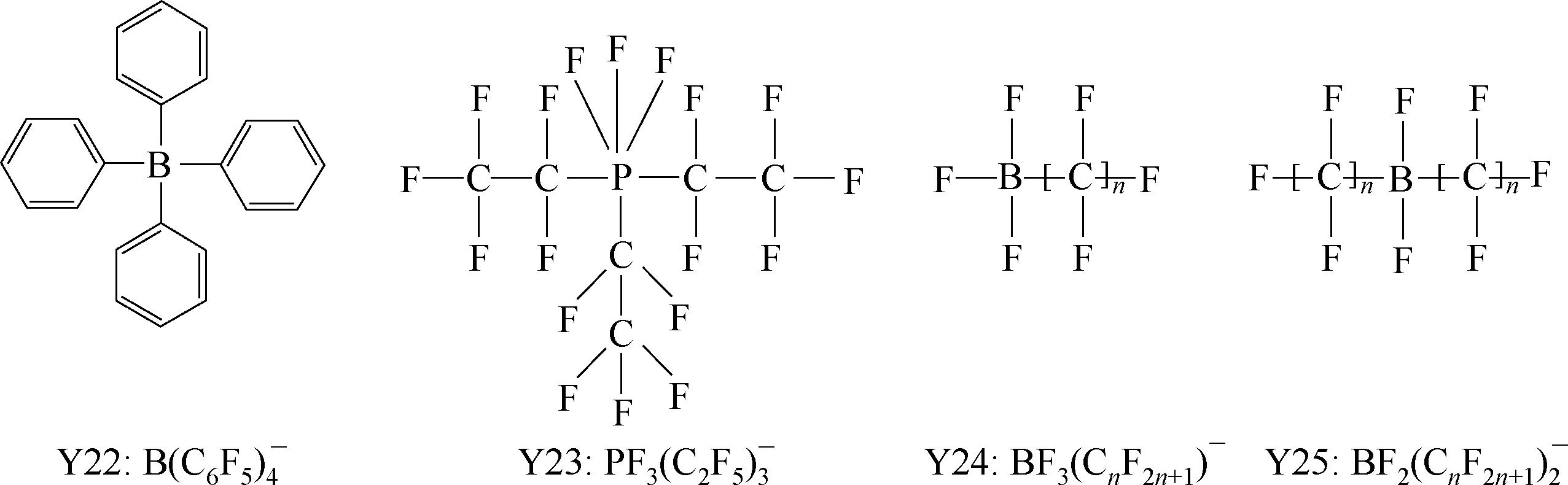
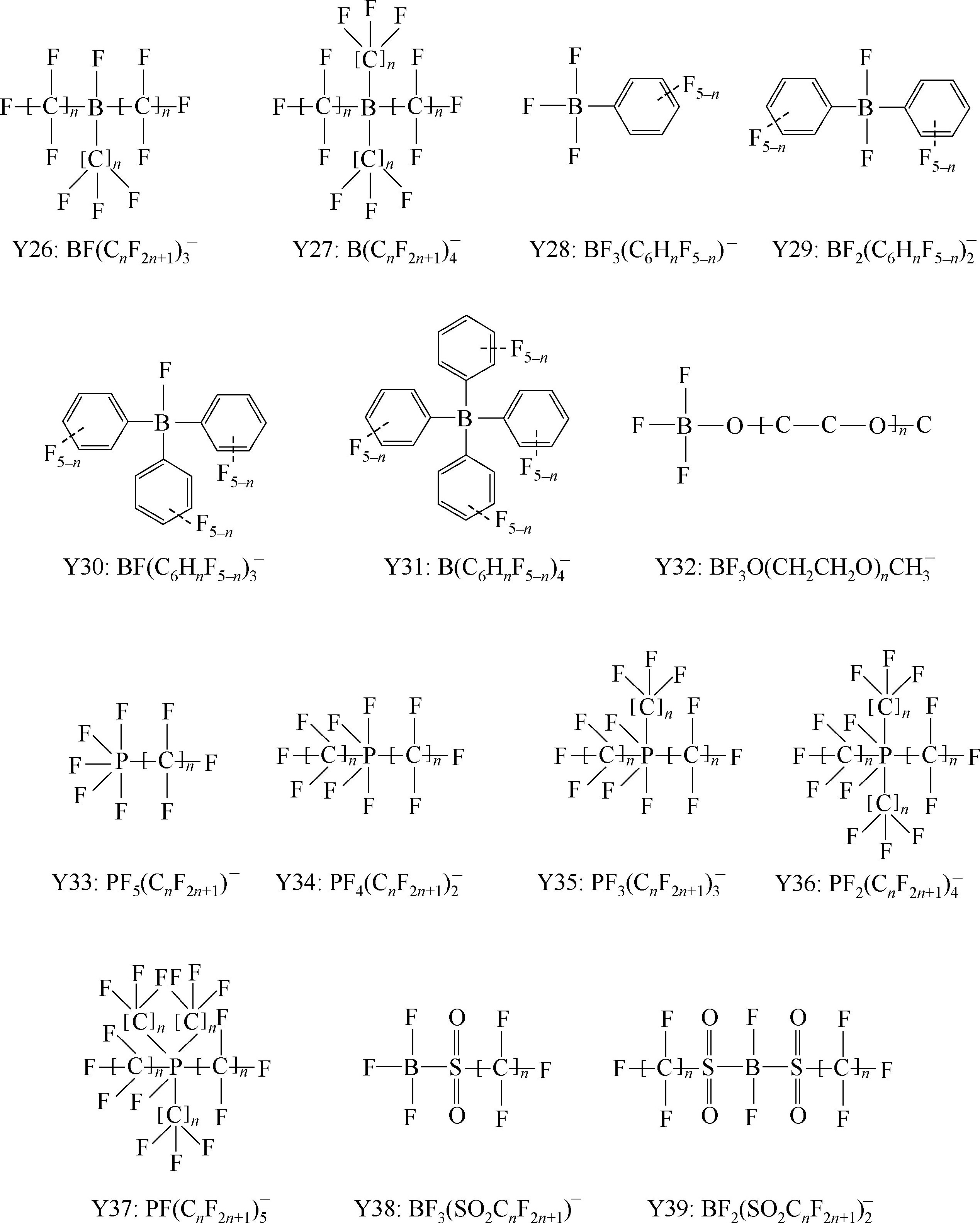
Y6~Y13为有机硼阴离子结构示意图,其中Y12
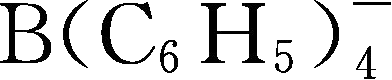 简写成
简写成
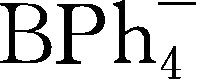 ,Y15 BF
3
(C
2
F
5
)
-
简写成FAB
-
;Y22
,Y15 BF
3
(C
2
F
5
)
-
简写成FAB
-
;Y22
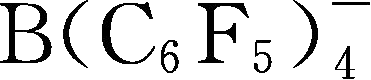 简写为BArF
-
,Y23
简写为BArF
-
,Y23
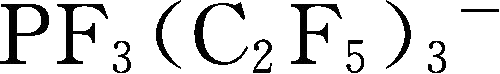 简写为FAP
-
。
简写为FAP
-
。
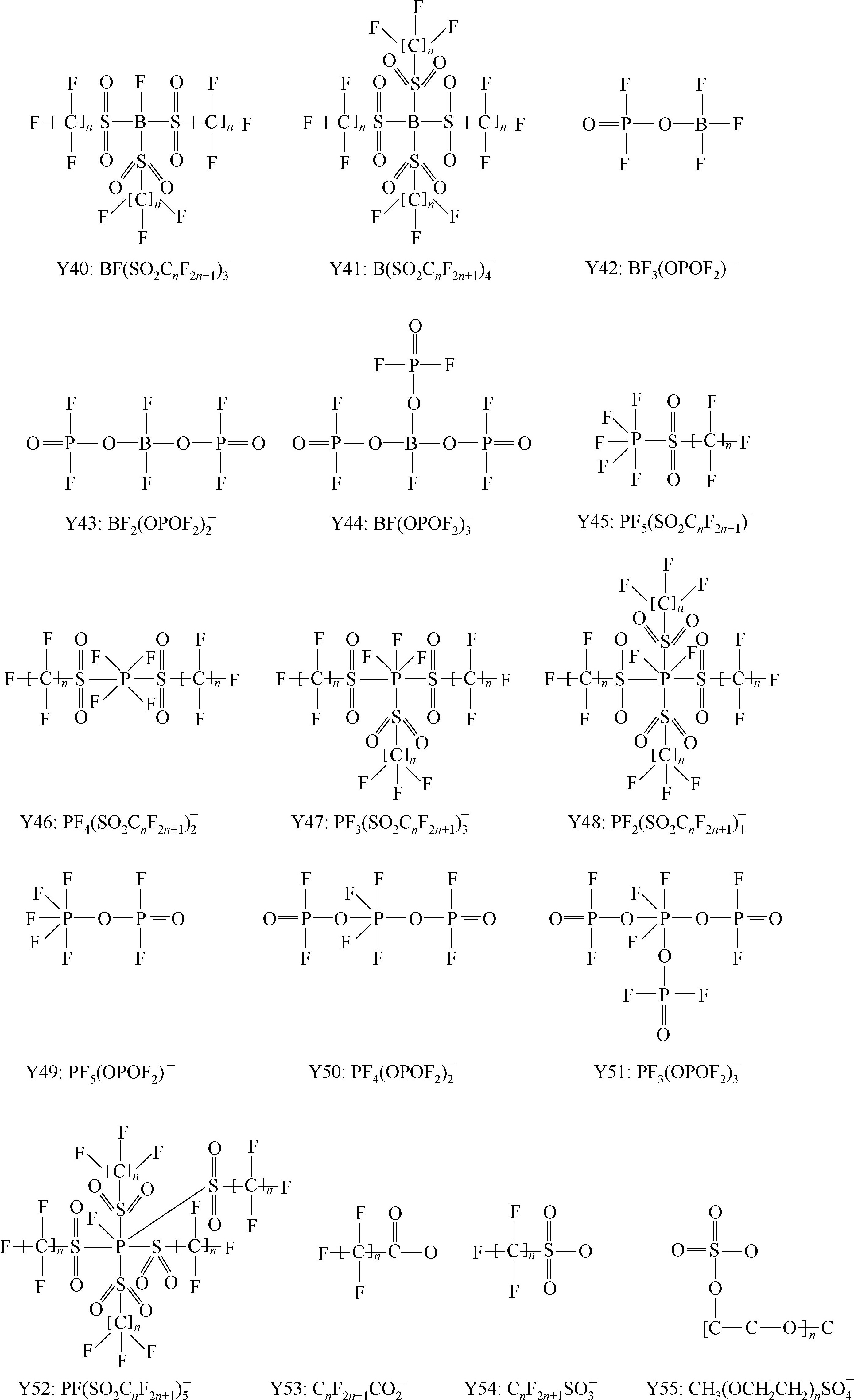
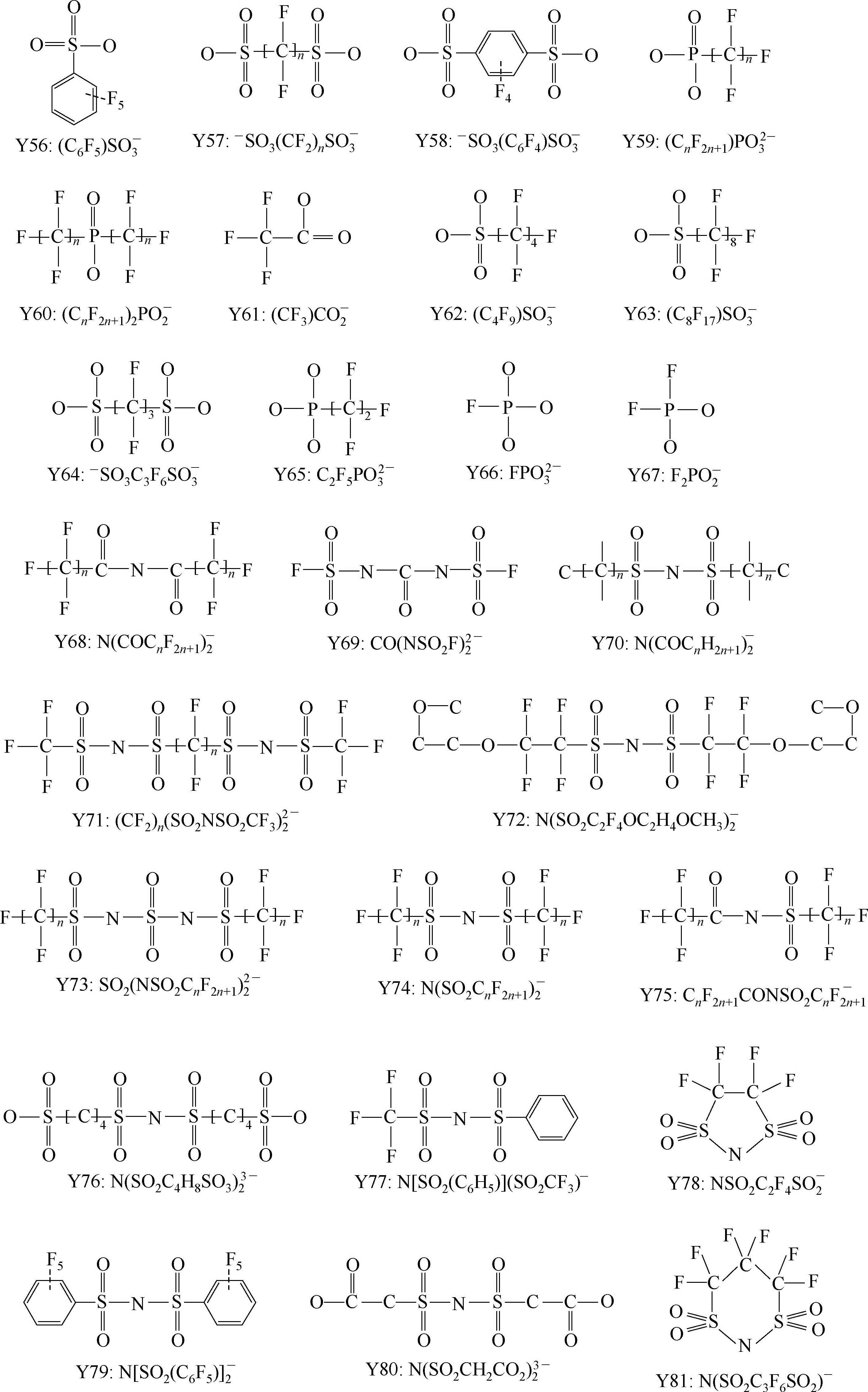
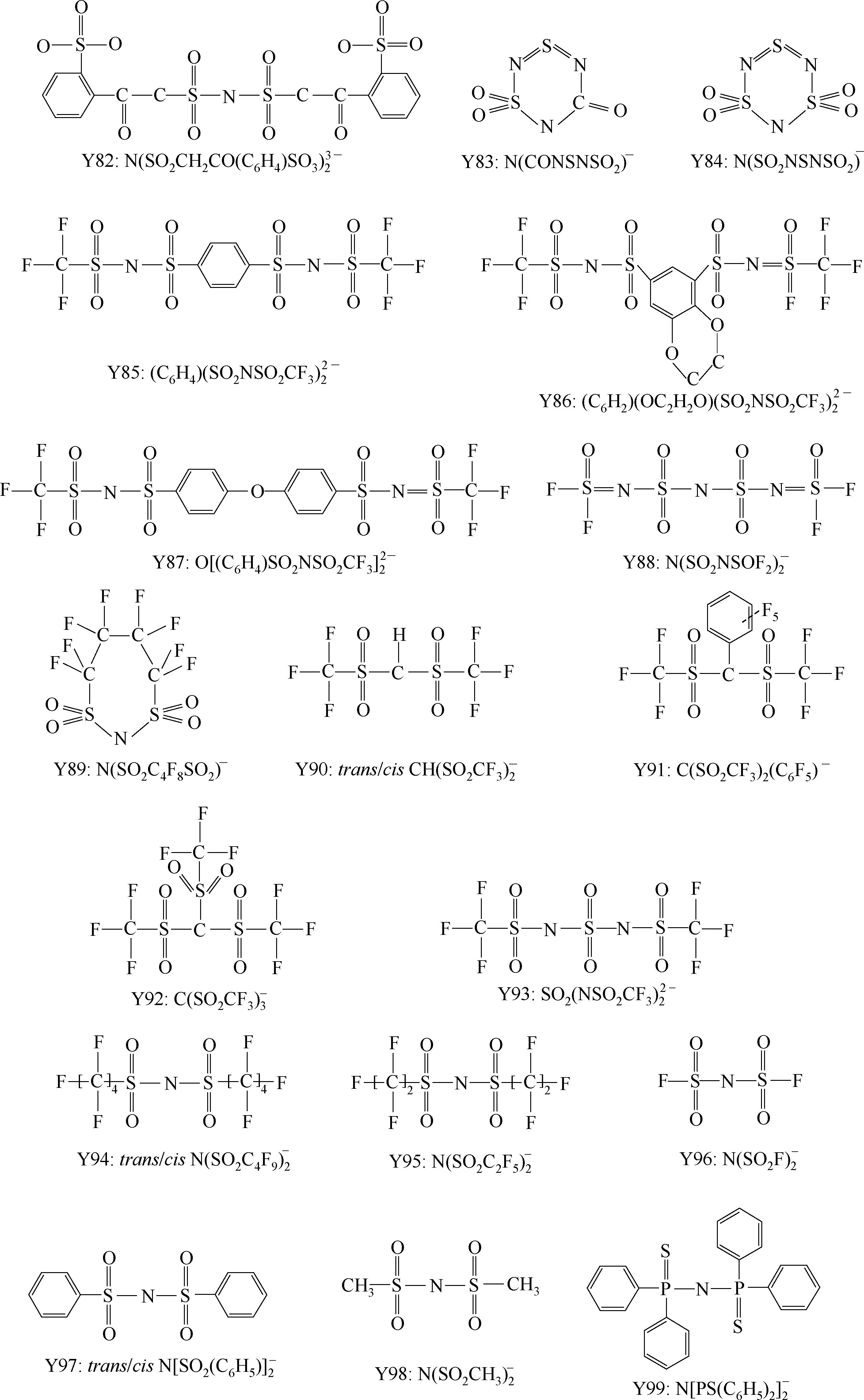
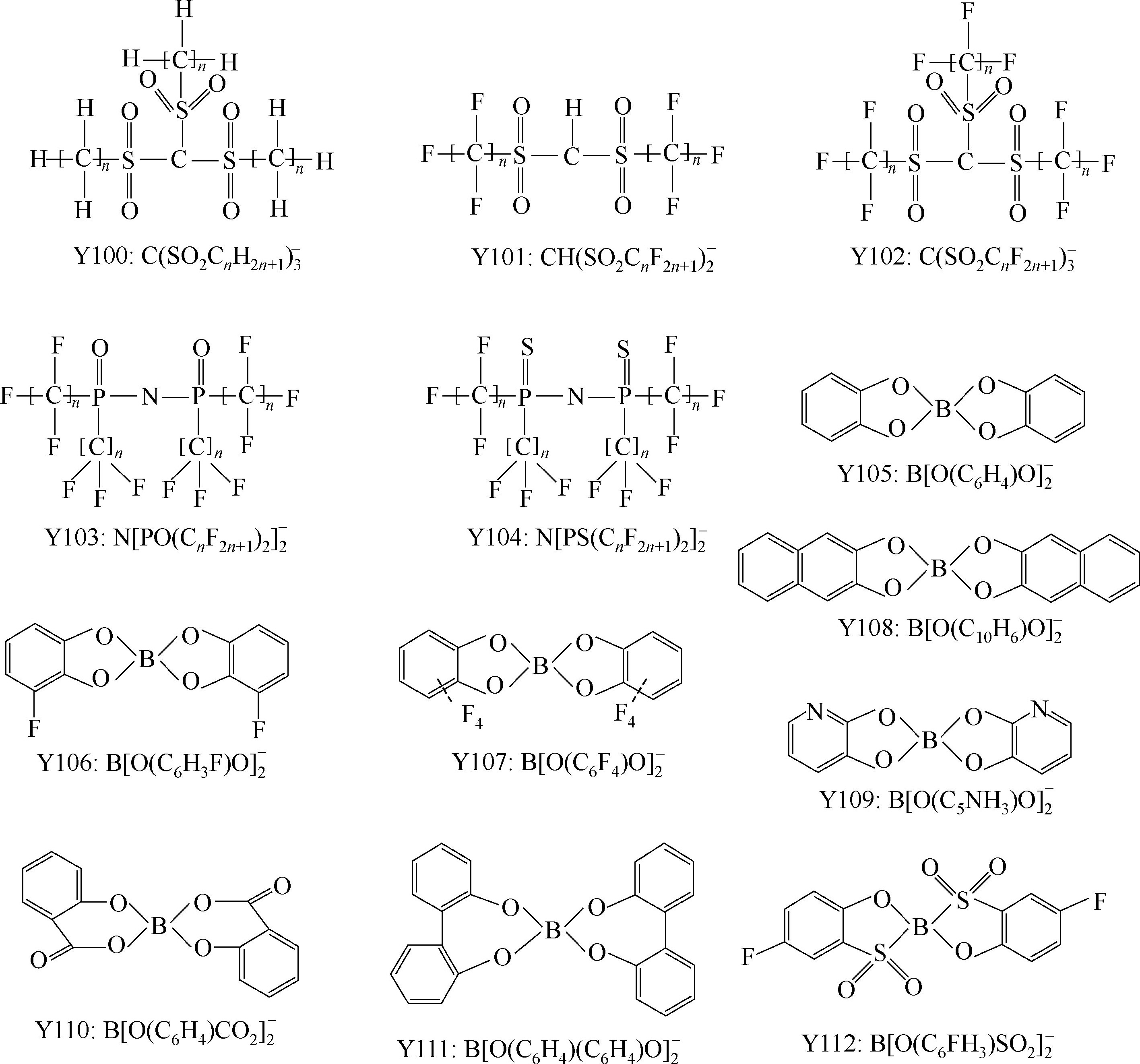
Y68~Y89为酰亚胺(imide)型阴离子; Y90
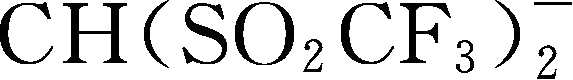 简写为TFSM
-
;Y92:
简写为TFSM
-
;Y92:
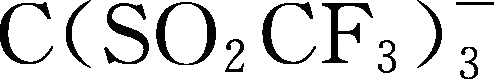 简写为TriTFSM
-
; Y95:
简写为TriTFSM
-
; Y95:
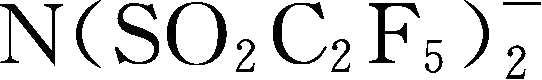 简写为BETI
-
;Y96:
简写为BETI
-
;Y96:
 简写为FSI
-
;Y101:
简写为FSI
-
;Y101:
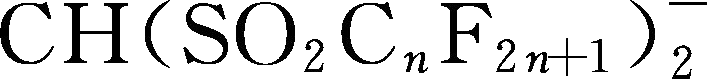 简写为TFSM
-
; Y102:
简写为TFSM
-
; Y102:
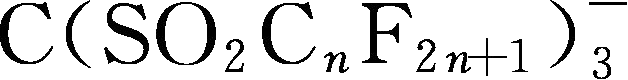 简写为TriTFSM
-
;Y100~Y102是Methide阴离子的典型例子;Y99和Y103、Y104是phosphorylimide阴离子的典型例子;Y105~Y112是螯合(chelated)有机硼阴离子典型;Y105:
简写为TriTFSM
-
;Y100~Y102是Methide阴离子的典型例子;Y99和Y103、Y104是phosphorylimide阴离子的典型例子;Y105~Y112是螯合(chelated)有机硼阴离子典型;Y105:
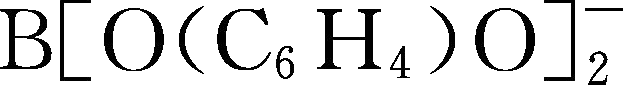 简写为BBB
-
;Y106:
简写为BBB
-
;Y106:
 简写为FLBBB
-
;Y107:
简写为FLBBB
-
;Y107:
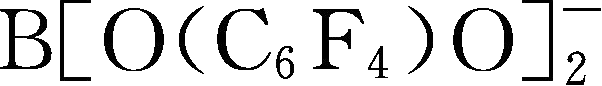 简写为4FLBBB
-
;Y108:
简写为4FLBBB
-
;Y108:
 简写为BNB
-
;Y109:
简写为BNB
-
;Y109:
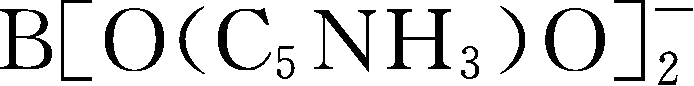 简写为BPB
-
;Y110:
简写为BPB
-
;Y110:
 简写为BSB
-
;Y111:
简写为BSB
-
;Y111:
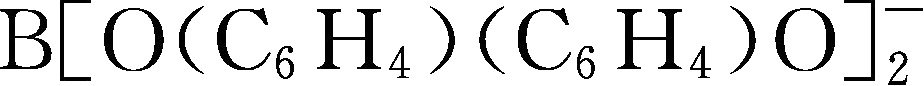 简写为BBPB
-
;Y112:
简写为BBPB
-
;Y112:
 简写为FSB
-
。
简写为FSB
-
。
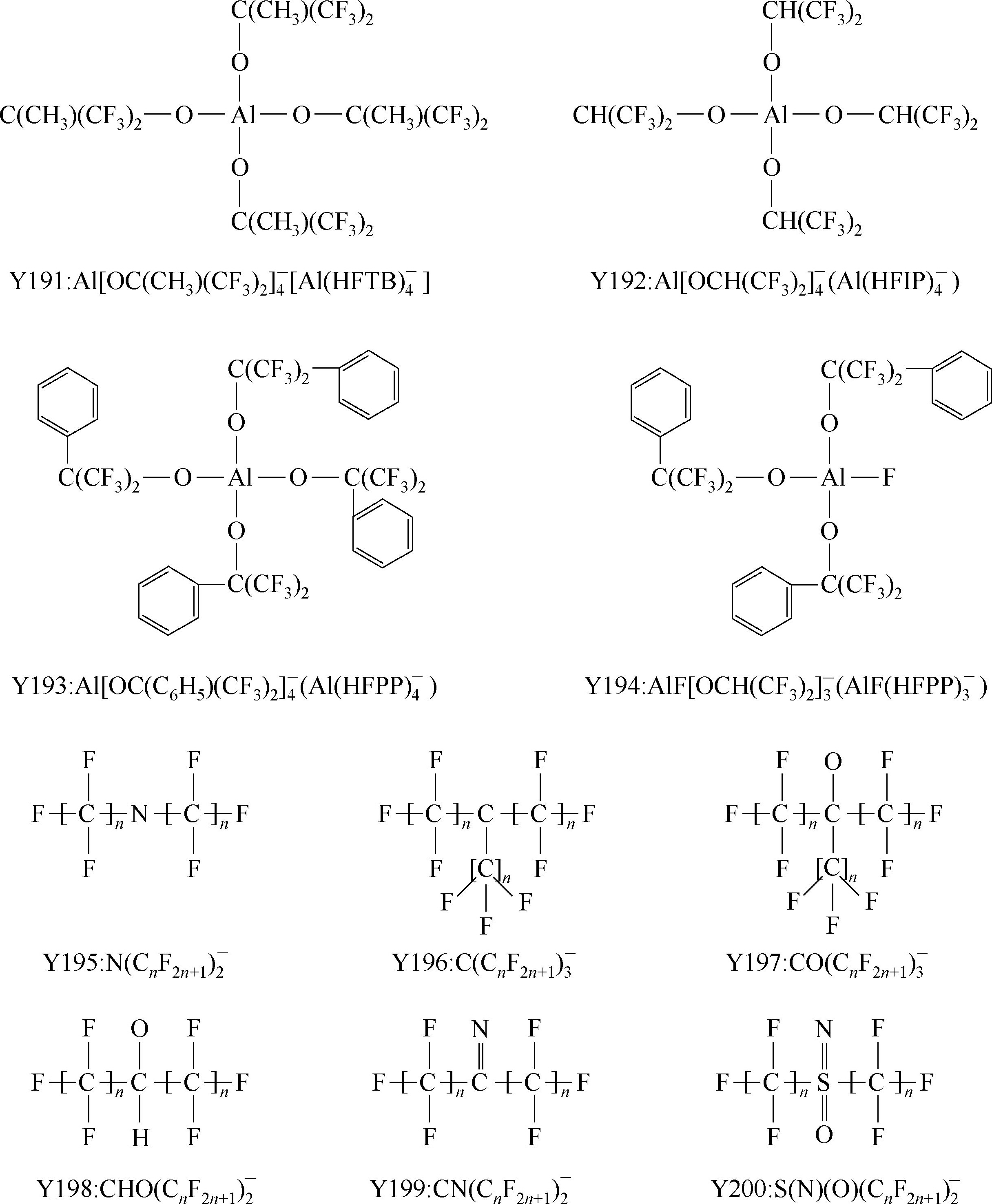
Y195~Y200: 典型的氟化酰胺(amide), 甲基化物(methide), 亚胺类(imine), 醇盐类( alkoxide),硫氧基亚胺类(sulfur oxyimine) 阴离子例子。
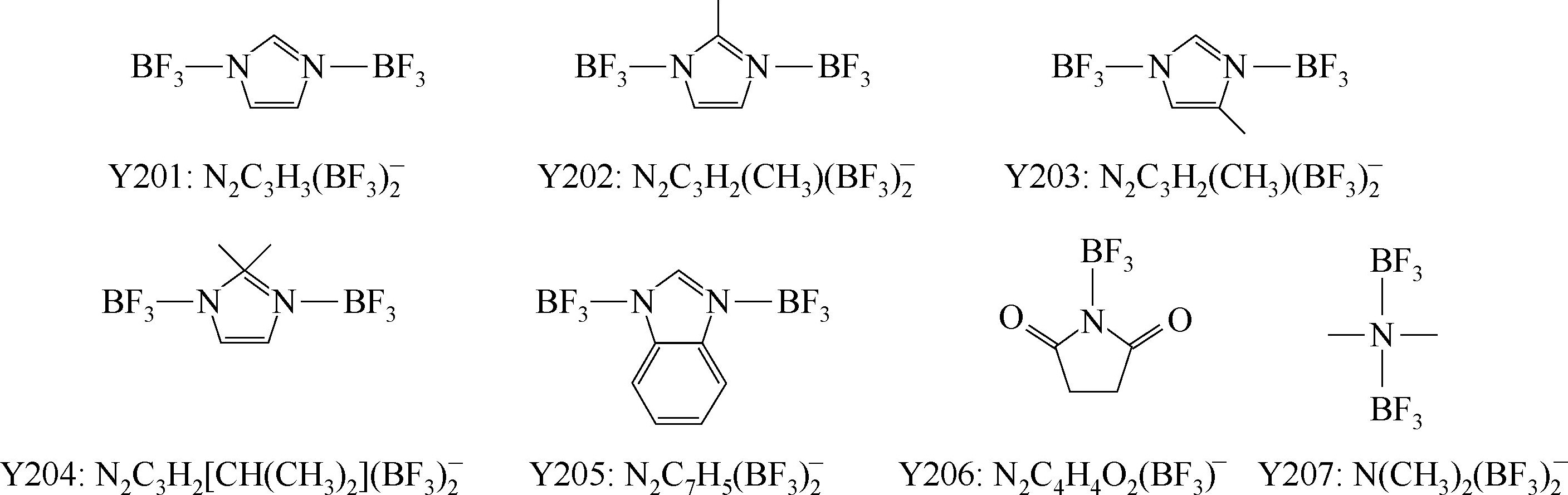
Y201~Y207: Lewis酸Lewis碱复合阴离子。
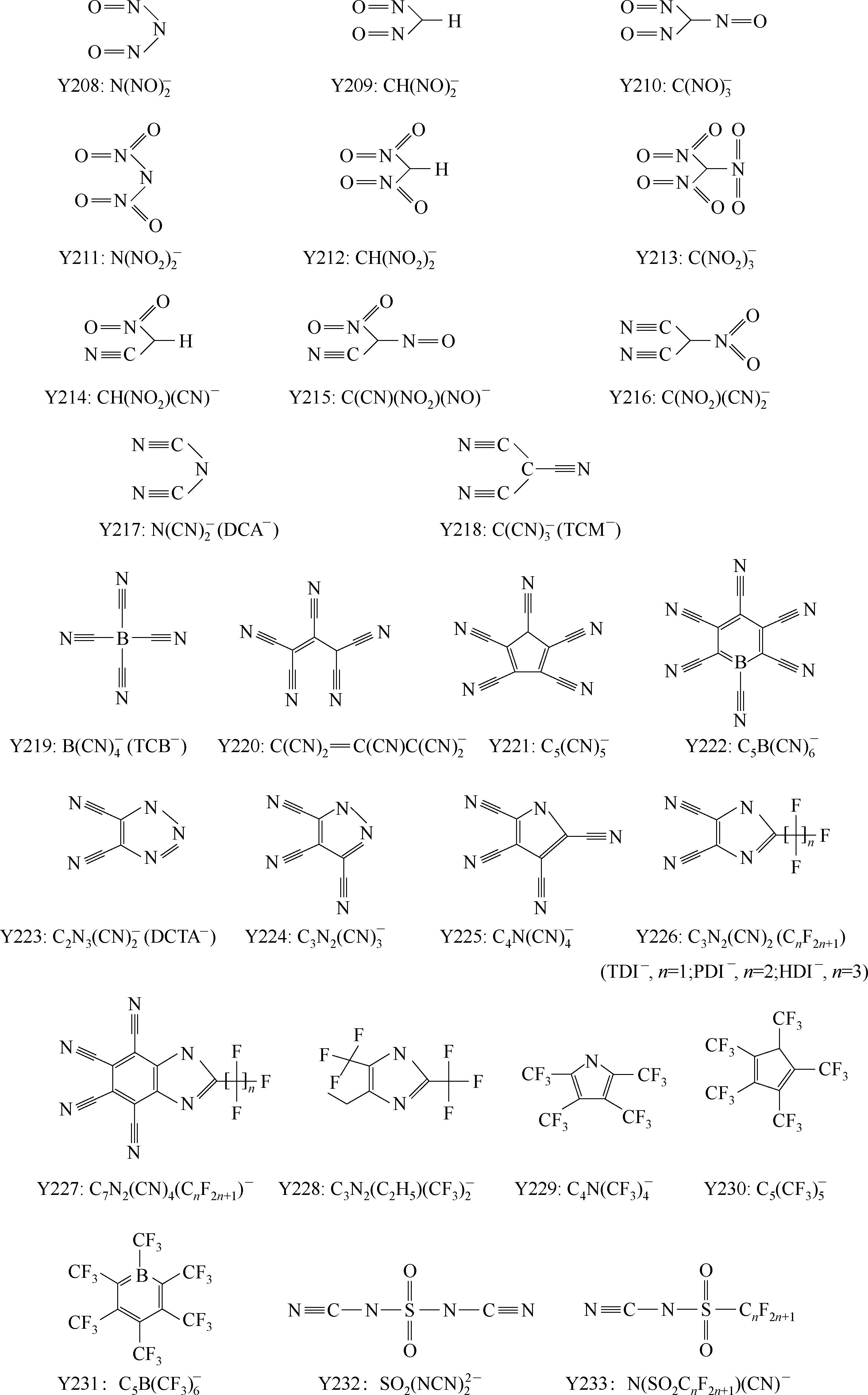
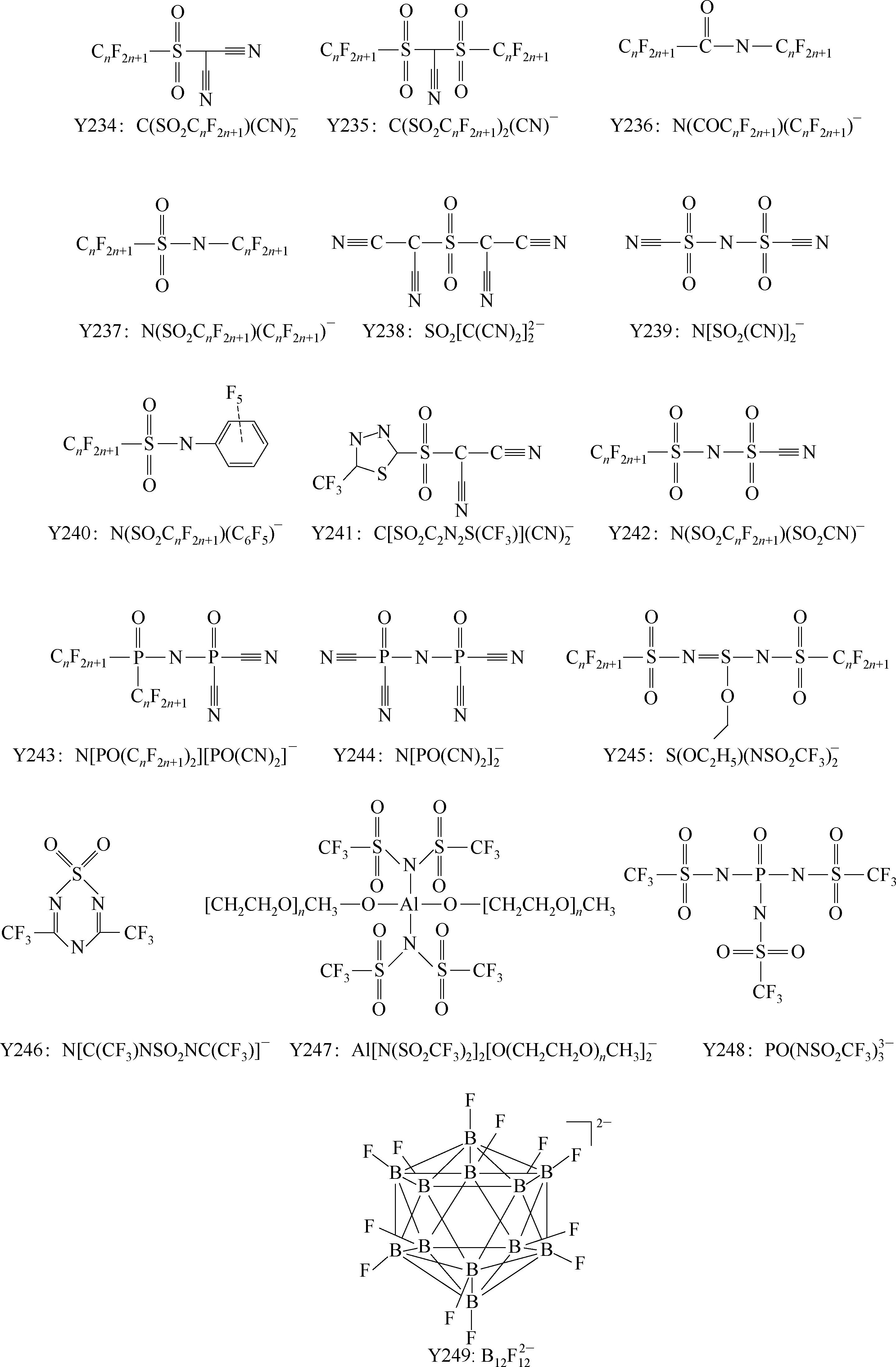
Y249为fluorinated closo-dodecaborate 阴离子。
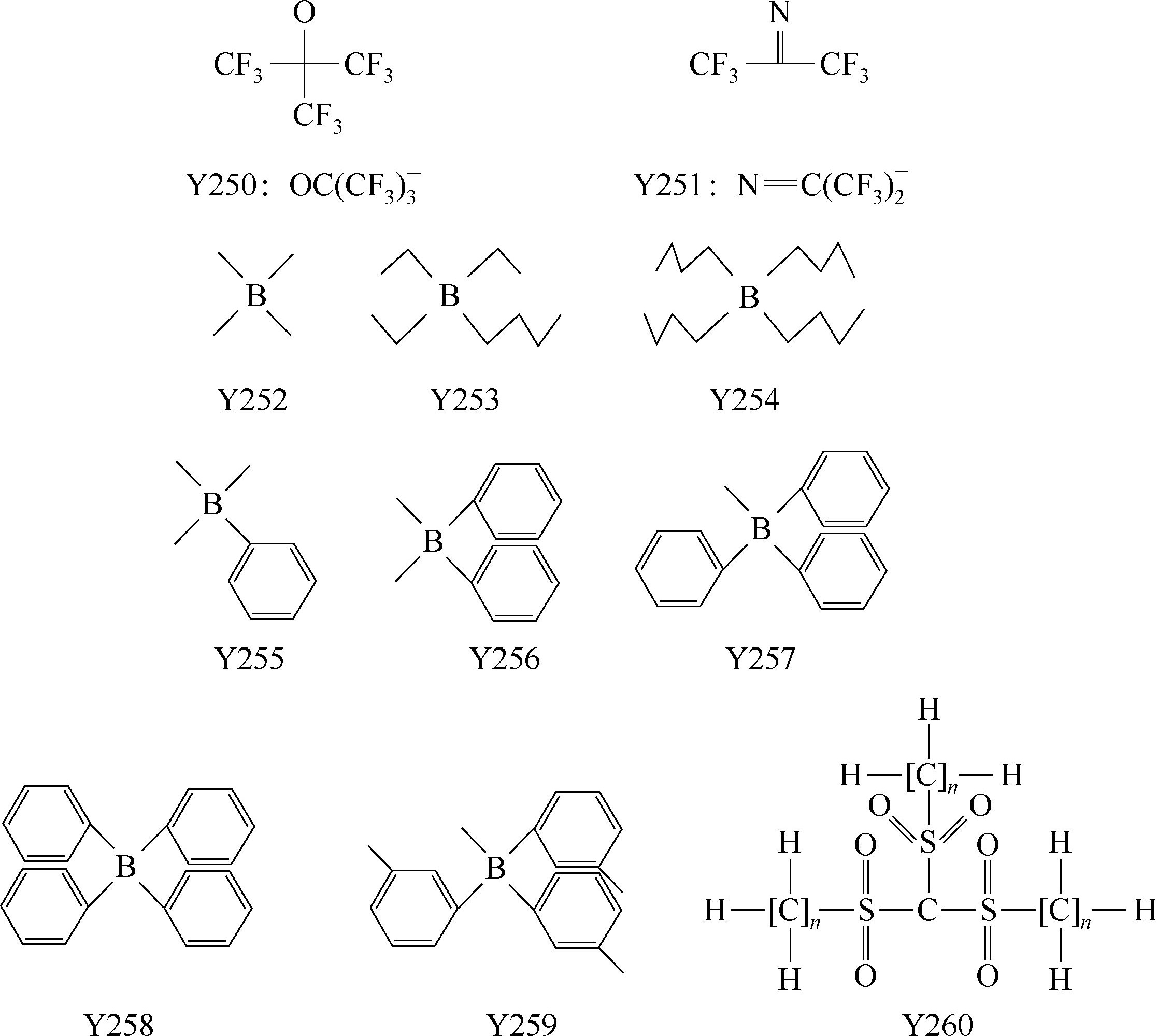
一些有机硼阴离子例子:Y252:
 ;Y253:B(C
2
H
5
)
3
(C
4
H
9
)
-
;Y254:
;Y253:B(C
2
H
5
)
3
(C
4
H
9
)
-
;Y254:
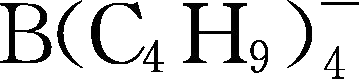 ;Y255:
;Y255:
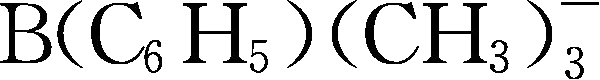 ;Y256:
;Y256:
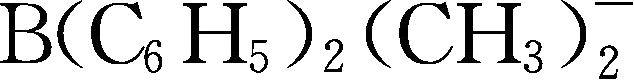 ;Y257:B(C
6
H
5
)
3
(CH
3
)
-
;Y258:
;Y257:B(C
6
H
5
)
3
(CH
3
)
-
;Y258:
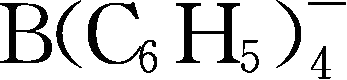 ;Y259:
;Y259:
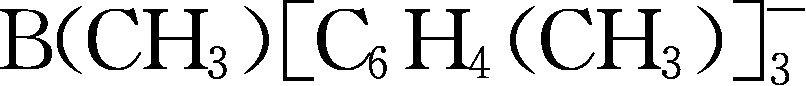 ;Y260为methide类阴离子,
;Y260为methide类阴离子,
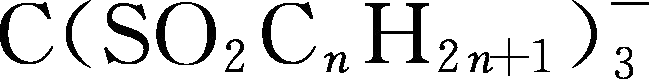 。
。
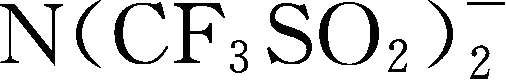 :简称为TSFI
-
;
:简称为TSFI
-
;
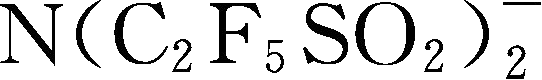 简称为BETI
-
;N(SO
2
CF
3
)(SO
2
C
4
F
9
)
-
缩写为TNSI
-
。
简称为BETI
-
;N(SO
2
CF
3
)(SO
2
C
4
F
9
)
-
缩写为TNSI
-
。