




【学习目标】
掌握沉淀滴定法的条件要求;常用沉淀滴定法——莫尔法 (铬酸钾指示剂法)、佛尔哈德法 (铁铵矾指示剂法)、法扬司法 (吸附指示剂法)的原理、特点、测定条件、适用范围、干扰因素及应用;标准溶液浓度表示的方法。
熟悉沉淀滴定法的应用和计算。
了解银量法的特点、滴定方式和测定对象。
引 子
巴比妥类药物(又称巴比妥酸盐,Barbiturate)是一类作用于中枢神经系统的镇静剂,属于巴比妥酸的衍生物,其应用范围可以从轻度镇静到完全麻醉,还可以用作抗焦虑药、安眠药、抗痉挛药,但长期使用会导致成瘾性。根据巴比妥类药物在适当的碱性溶液中易与重金属离子反应,并可定量地形成盐的化学性质,可采用银量法进行本类药物的含量测定。巴比妥类药物首先形成可溶性的一银盐,当被测供试品完全形成一银盐后,继续用硝酸银滴定稍过量的银离子,就与巴比妥类药物形成难溶性的二银盐,使溶液变浑浊,以指示滴定终点。
沉淀滴定法是以沉淀反应为基础的一种滴定分析方法。虽然沉淀反应很多,但是能用于滴定分析的沉淀反应必须符合下列几个条件:
1.沉淀反应必须迅速,并按一定的化学计量关系进行。
2.生成的沉淀应具有恒定的组成,而且溶解度必须很小。
3.有确定化学计量点的简单方法。
4.沉淀的吸附现象不影响滴定终点的确定。
由于上述条件的限制,能用于沉淀滴定法的反应并不多,目前有实用价值的主要是形成难溶性银盐的反应,例如:
Ag + +Cl - =AgCl↓(白色)
Ag + +SCN - =AgSCN↓(白色)
这种利用生成难溶银盐反应进行沉淀滴定的方法称为银量法(aregentometric method)。银量法主要用于测定Cl - 、Br - 、I - 、Ag + 、CN - 、SCN - 等离子,也可以测定经处理后能定量产生这些离子的有机物。
除银量法外,Ba
2+
(Pb
2+
)与
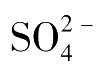 、Hg
2+
与S
2-
、K
4
[Fe(CN)
6
]与
、Hg
2+
与S
2-
、K
4
[Fe(CN)
6
]与
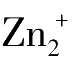 、NaB(C
6
H
5
)
4
与K
+
等形成沉淀的反应也可以用于滴定,例如K
4
[Fe(CN)
6
]与
、NaB(C
6
H
5
)
4
与K
+
等形成沉淀的反应也可以用于滴定,例如K
4
[Fe(CN)
6
]与
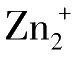 、NaB(C
6
H
5
)
4
与 K
+
的反应:
、NaB(C
6
H
5
)
4
与 K
+
的反应:
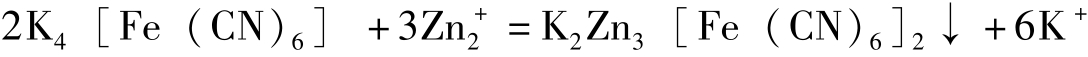
NaB(C 6 H 5 ) 4 +K + =KB(C 6 H 5 ) 4 ↓ +Na +
但其实际应用不及银量法普遍,本章将着重讨论银量法。根据滴定方式的不同、银量法可分为直接法和间接法。直接法是用AgNO 3 标准溶液直接滴定待测组分的方法;间接法是先于待测试液中加入一定量的AgN0 3 标准溶液,再用NH 4 SCN标准溶液来滴定剩余的AgN0 3 溶液的方法。
1.滴定曲线 沉淀滴定法在滴定过程中的溶液离子浓度(或其负对数)的变化情况也可以用滴定曲线表示。以 AgNO 3 溶液(0.1000mol/L)滴定 20.00mL NaCl溶液(0.1000mol/L)为例:
(1)滴定开始前:
[Cl - ]=0.1000mol/L pCl=-lg1.000×10 -1 =1.00
(2)滴定开始至化学计量点前:溶液中的氯离子浓度,取决于剩余的氯化钠的浓度。例如,加入AgNO 3 溶液18.00mL时:
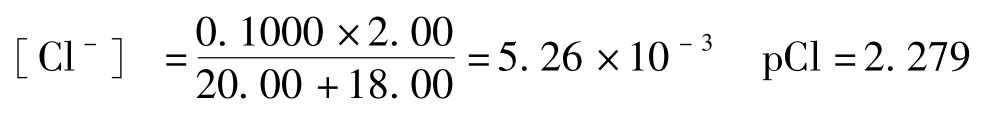
因为 [Ag + ][Cl - ]= K sp =1.56×10 -10
pAg+pCl=-lg K sp =9.807
故pAg=9.087-2.279=7.537
同理,当加入AgNO 3 溶液19.98mL时,溶液中剩余的Cl - 浓度为:
[Cl - ]=5.0×10 -5 pCl=4.30 pAg=5.51
(3)化学计量点时:溶液是AgCl的饱和溶液。
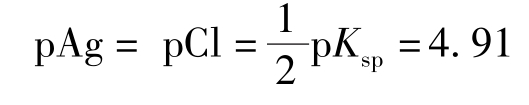
(4)化学计量点后:溶液的Ag + 溶液浓度由过量的AgNO 3 溶液浓度决定,当加入Ag-NO 3 溶液20.02mL时(过量0.02mL),则 [Ag + ]=5.0×10 -5 mol/L,因此:
pAg=4.30 pCl=9.81-4.30=5.51
用这些计算数据描绘成的滴定曲线有以下特点:
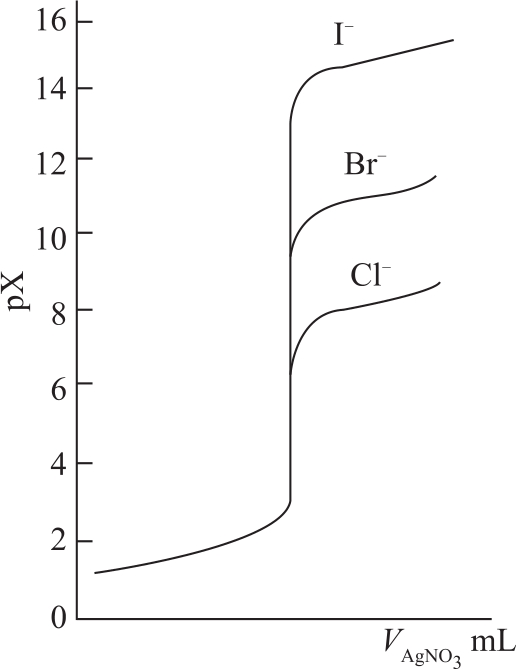
图5-1 AgNO 3 溶液滴定Cl - 、Br - 和I - 的滴定曲线
(1)pX与pAg两条曲线以化学计量点对称。这表示随着滴定的进行,溶液中Ag + 浓度增加时,X - 浓度以相同的比例减小;而化学计量点时,两种离子浓度相等,即两条曲线在化学计量点相交。
(2)与酸碱滴定曲线相似,滴定开始时溶液X - 浓度较大,滴入Ag + 所引起的X - 浓度改变不大,曲线比较平坦;近化学计量点时,溶液中X - 浓度已很小,再滴入少量Ag + 即引起X - 浓度发生很大变化而形成突跃。
(3)突跃范围的大小,取决于沉淀的溶度积常数 K sp 和溶液的浓度。 K sp 越小,突跃范围大,如 K sp (AgI)< K sp (AgCl),所以相同浓度的Cl - 、Br - 和I - 与Ag + 的滴定曲线上,突跃范围是I - 的最大,Cl - 的最小。若溶液的浓度较低,则突跃范围变小,这与酸碱滴定法相同。
2.分步滴定 溶液中如果同时含有Cl - 、Br - 和I - 离子时,由于AgI、AgBr、AgCl的溶度积差别较大,当浓度差别不太大时,可利用分步滴定的原理,用AgNO 3 溶液连续滴定,测出它们各自的含量。溶度积最小的AgI被最先滴定,AgCl被最后滴定。在滴定曲线上显示出3个突跃。但是,由于卤化银沉淀的吸附和生成混晶的作用,常会引起误差。因此,实际的滴定结果往往并不理想。
1.基准物质 银量法常用的基准物质是市售的一级纯硝酸银(或基准硝酸银)和氯化钠。
硝酸银的市售品若纯度不够,可以在硝酸银中重结晶纯制。精制过程应避光并避免有机物(如滤纸纤维),以免Ag + 被还原。所得结晶可在100℃干燥除去表面水;在200~250℃干燥15分钟除去包埋水。AgNO 3 纯品不易吸潮,密闭避光保存。
氯化钠也有基准品规格试剂,也可用一般试剂级规格的氯化钠进行精制。氯化钠极易吸潮,应置于干燥器中保存。
2.标准溶液 硝酸银标准溶液可用定重法精密称取基准硝酸银,加水溶解定容制成。也可用分析纯硝酸银配制,再用基准NaCl标定。硝酸银标准溶液见光容易分解,应于棕色瓶中避光保存。但存放一段时间后,还应重新标定。标定方法最好采用与样品测定相同,以消除方法误差。
硫氰酸铵(或硫氰酸钾)标准溶液可用已标定好的AgNO 3 标准溶液,按铁铵矾指示剂法的直接滴定法进行标定。
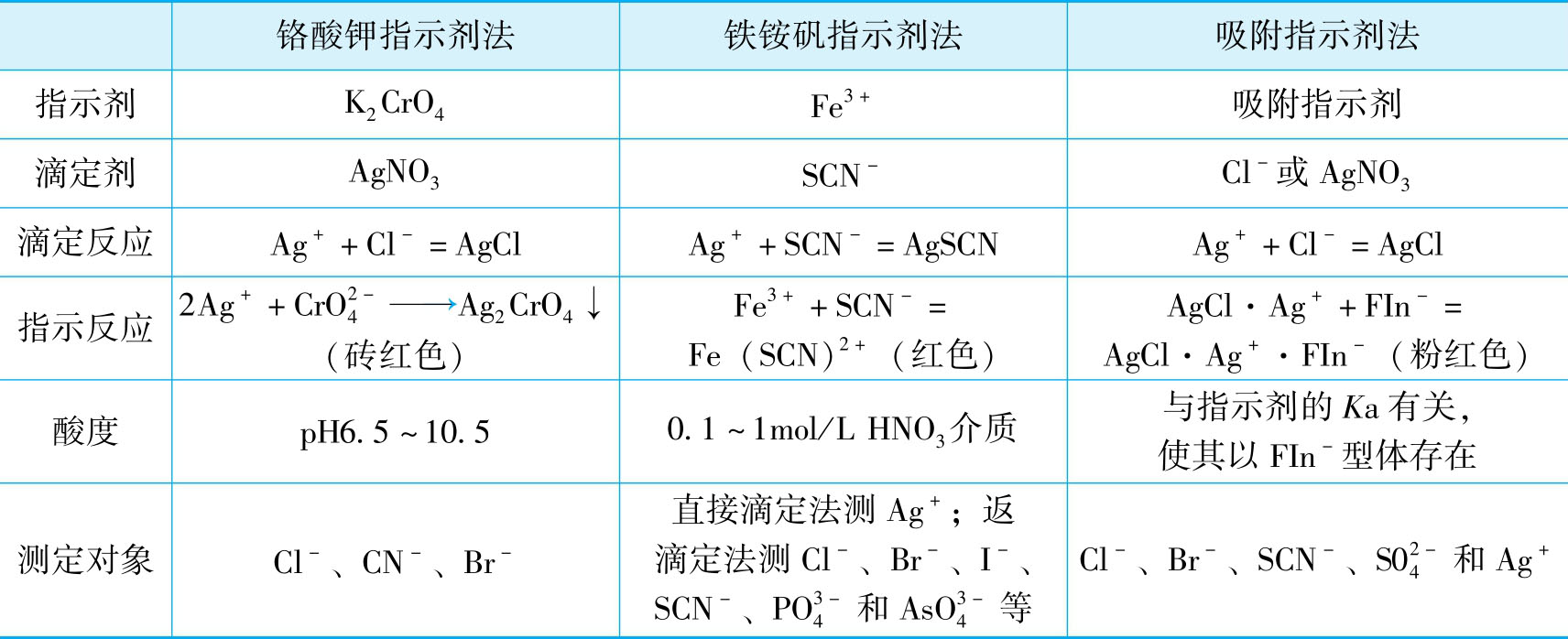
根据确定滴定终点所采用的指示剂不同,银量法分为铬酸钾指示剂法(Mohr法)、铁铵矾指示剂法(Volhard法)和吸附指示剂法(Fajans法)。
铬酸钾指示剂法是以K 2 CrO 4 为指示剂,在中性或弱碱性介质中用AgNO 3 标准溶液测定卤素混合物含量的方法。
用AgNO 3 标准溶液直接滴定Cl - (或Br - )时,以K 2 CrO 4 作指示剂,其反应为:
滴定反应:Ag + +Cl - =AgCl↓白色 K sp =1.56×10 -10
指示终点反应:2 Ag
+
+
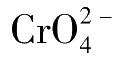 =Ag
2
CrO
4
↓砖红色
K
sp
=1.10×10
-12
=Ag
2
CrO
4
↓砖红色
K
sp
=1.10×10
-12
这个方法的依据是多级沉淀原理,由于AgCl的溶解度比Ag
2
CrO
4
的溶解度小,根据分步沉淀的原理,在用AgNO
3
标准溶液滴定时,首先发生滴定反应析出白色的AgCl沉淀。当滴定剂Ag
+
与Cl
-
达到化学计量点时,Cl
-
被定量沉淀后,稍过量的Ag
+
与
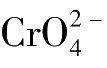 反应析出砖红色的Ag
2
CrO
4
沉淀,指示滴定终点的到达。
反应析出砖红色的Ag
2
CrO
4
沉淀,指示滴定终点的到达。
1.指示剂的用量
用AgNO
3
标准溶液滴定Cl
-
,指示剂K
2
CrO
4
的用量对于终点指示有较大的影响,指示剂
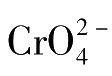 的浓度必须合适。
的浓度必须合适。
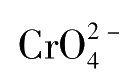 浓度过高或过低,Ag
2
CrO
4
沉淀的析出就会过早或过迟,会产生一定的终点误差。若太大将会引起终点提前,且
浓度过高或过低,Ag
2
CrO
4
沉淀的析出就会过早或过迟,会产生一定的终点误差。若太大将会引起终点提前,且
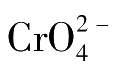 本身的黄色会影响对终点的观察;若太小又会使终点滞后。为使终点的显示尽可能接近化学计量点,终点时AgNO
3
不能过量太多,这要求铬酸钾溶液应有足够的浓度。例如,滴定到达终点时溶液总体积约50mL,所消耗的AgNO
3
溶液(0.1mol/L)约20mL,若终点时允许有0.05%的滴定剂过量,即多加入AgNO
3
溶液0.01mL,此时过量Ag
+
的浓度为:
本身的黄色会影响对终点的观察;若太小又会使终点滞后。为使终点的显示尽可能接近化学计量点,终点时AgNO
3
不能过量太多,这要求铬酸钾溶液应有足够的浓度。例如,滴定到达终点时溶液总体积约50mL,所消耗的AgNO
3
溶液(0.1mol/L)约20mL,若终点时允许有0.05%的滴定剂过量,即多加入AgNO
3
溶液0.01mL,此时过量Ag
+
的浓度为:
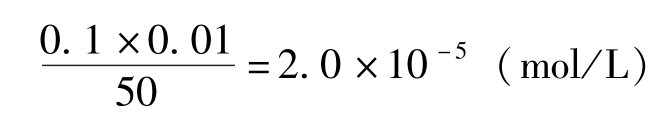
为使Ag
+
浓度达到2.0×10
-5
mol/L时,即开始产生Ag
2
CrO
4
沉淀,则
 离子浓度应达到:
离子浓度应达到:
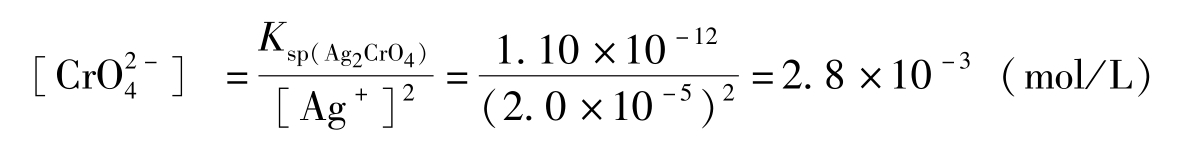
实际滴定时,通常在反应液总体积为50~100mL的溶液中加入5%铬酸钾指示剂1~2mL,此时 [
 ]为(5.2~2.6)×10
-3
mol/L。若反应液总体积达到100mL时,AgNO
3
(0.1mol/L)溶液约过量0.02mL。
]为(5.2~2.6)×10
-3
mol/L。若反应液总体积达到100mL时,AgNO
3
(0.1mol/L)溶液约过量0.02mL。
以上计算未计入由于AgX沉淀溶解所产生的Ag + 。对于溶度积小的AgBr,由沉淀溶解产生的Ag + 可以忽略不计;但滴定氯化物时,当Ag + 浓度达到2.0×10 -5 mol/L时实际上约有40%的Ag + 来自AgCl沉淀的溶解,因而所需滴定剂的过量也少一些,即终点与化学计量点更接近些。
值得注意的是,在滴定过程中,AgNO 3 标准溶液的总消耗量应适当。若标准溶液体积消耗太小,或标准溶液浓度过低,都会因为终点的过量使测定结果的相对误差增大。为此,必要时须做指示剂的“空白校正”。校正方法是将1mL指示剂加到50mL水中,或加到无Cl - 且含少许CaCO 3 的混悬液中,用AgNO 3 标准溶液滴定至同样的终点颜色,记下读数,然后从试样滴定所消耗的AgNO 3 标准溶液的体积中扣除空白消耗值。
2.溶液的酸度
滴定应在中性或微碱性介质中进行,若酸度过高,CrO
2-
4
将因酸效应致使其浓度降低,导致Ag
2
CrO
4
沉淀出现过迟甚至不沉淀;但溶液的碱性太强,又将生成Ag
2
O沉淀,故适宜的酸度范围为pH值6.5~10.5。若试液中有铵盐存在,在碱性溶液中它与Ag
+
生成Ag(NH
3
)
+
或 [Ag(NH
3
)
2
]
2+
,致使AgCl和Ag
2
CrO
4
的溶解度增大,测定的准确度降低。实验证明,当
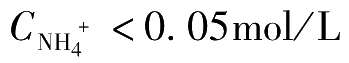 时,控制溶液的pH值在6.5~7.2范围内,滴定可能得到满意的结果。若
时,控制溶液的pH值在6.5~7.2范围内,滴定可能得到满意的结果。若
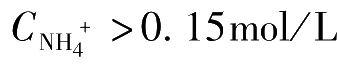 时,则仅仅通过控制溶液酸度已不能消除其影响,此时须在滴定前将大量铵盐除去。
时,则仅仅通过控制溶液酸度已不能消除其影响,此时须在滴定前将大量铵盐除去。
3.滴定时应剧烈振摇 使被AgCl或AgBr沉淀吸附的Cl - 或Br - 及时释放出来,防止终点提前。
4.预先分离干扰离子
铬酸钾指示剂法的选择性较差,凡与Ag
+
能生成沉淀的阴离子如
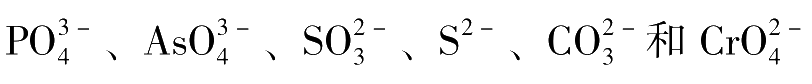 等;与
等;与
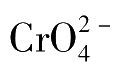 能生成沉淀的阳离子如Ba
2+
、Pb
2+
、Hg
2+
等,大量Cu
2+
、Co
2+
、Ni
2+
等有色离子,以及在中性或弱碱性溶液中易发生水解反应的离子如Fe
3+
、Al
3+
、Bi
3+
和Sn
4+
等均干扰测定,应预先分离。
能生成沉淀的阳离子如Ba
2+
、Pb
2+
、Hg
2+
等,大量Cu
2+
、Co
2+
、Ni
2+
等有色离子,以及在中性或弱碱性溶液中易发生水解反应的离子如Fe
3+
、Al
3+
、Bi
3+
和Sn
4+
等均干扰测定,应预先分离。
本法主要用于Cl - 、Br - 和CN - 的测定,不适用于滴定I - 和SCN - 。这是因为AgI和AgSCN沉淀对I - 和SCN - 有较强烈的吸附作用,即使剧烈振摇也无法使之释放出来。也不适用于以NaCl标准溶液直接滴定Ag + ,因为在Ag + 试液中加入指示剂K 2 CrO 4 后,就会立即析出Ag 2 CrO 4 沉淀,用NaCl标准溶液滴定时,Ag 2 CrO 4 再转化成AgCl的速率极慢,使终点推迟。因此,如用铬酸钾指示剂法测定Ag + ,则必须采用返滴定法,即先加入一定量且过量的NaCl标准溶液,然后再加入指示剂,用AgNO 3 标准溶液返滴定剩余的Cl - 。
铁铵矾指示剂法是在酸性介质中以铁铵矾 [NH 4 Fe(SO 4 ) 2 ·12H 2 O]作指示剂来确定滴定终点的一种银量法。根据滴定方式的不同,分为直接滴定法和返滴定法两种。
1.直接滴定法 在酸性条件下,以铁铵矾作指示剂,用KSCN或NH 4 SCN标准溶液直接滴定溶液中的Ag + ,当滴定到化学计量点时,微过量的SCN - 与Fe 3+ 结合生成红色的FeSCN 2+ 即为滴定终点。其反应是:
滴定反应:Ag + +SCN - ══AgSCN↓(白色) K sp(AgSCN) =1.0×10 -12
指示终点反应:Fe 3+ +SCN - ══FeSCN 2+ (红色) K =138
滴定时,溶液的酸度一般控制在0.1~1mol/L之间。由于指示剂在中性或碱性溶液中将形成Fe(OH) + 、Fe(OH) 2+ 等深色配合物,碱度再大,还会产生Fe(OH) 3 沉淀。酸度过低,Fe 3+ 易水解。为使终点时刚好能观察到FeSCN 2+ 的最低浓度为6×10 -6 mol/L。要维持FeSCN 2+ 的配位平衡,Fe 3+ 的浓度应远远高于这一数值,但Fe 3+ 的浓度过大,它的黄色会干扰终点的观察。因此,终点时Fe 3+ 的浓度一般控制在0.015mol/L。
在滴定过程中,用NH 4 SCN溶液滴定Ag + 溶液时,生成的AgSCN沉淀具有强烈的吸附作用,所以有部分Ag + 被吸附于其表面上,使Ag + 浓度降低,以致红色的出现略早于化学计量点。因此往往产生终点过早的情况,使结果偏低。滴定时,必须充分振摇,使被吸附的Ag + 及时地释放出来。
此法的优点在于可用来直接测定Ag + ,并可在酸性溶液中进行滴定。
2.返滴定法 在含有卤素离子的HNO 3 溶液中,必须加入一定量过量的AgNO 3 溶液之后再加入铁铵矾指示剂,以免I - 对Fe 3+ 的还原作用而造成误差。强氧化剂和氮的氧化物,以及铜盐、汞盐都与SCN - 作用,因而干扰测定,必须预先除去。以铁铵矾为指示剂,用NH 4 SCN标准溶液返滴定过量的AgNO 3 。
滴定前反应:Ag
+
+X
-
 AgX↓
AgX↓
定量,过量
滴定反应:Ag
+
+SCN
-
 AgSCN↓
AgSCN↓
剩余量
指示终点反应:SCN
-
+Fe
3+
 Fe(SCN)
2+
(红色)
Fe(SCN)
2+
(红色)
由于滴定是在HNO
3
介质中进行的,许多弱酸盐如
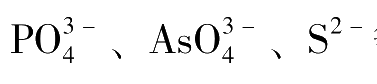 等都不干扰卤素离子的测定,因此此法选择性高。
等都不干扰卤素离子的测定,因此此法选择性高。
应用此法测定Cl - 时,由于AgCl的溶解度比AgSCN大,当剩余的Ag + 被滴定完之后,过量的SCN - 将与AgCl发生沉淀转化反应:
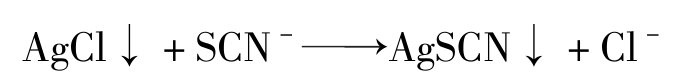
该反应使得本应产生的 [FeSCN] 2+ 红色不能及时出现,或已经出现的红色随着振摇而又消失。因此,要得到持久的红色就必须继续滴入SCN - ,直到SCN - 与Cl - 之间建立以下平衡为止:
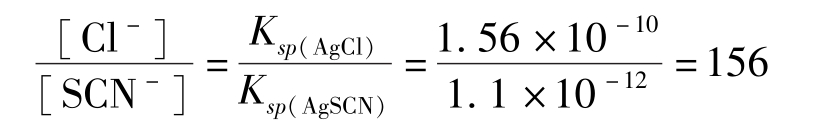
无疑多消耗了NH 4 SCN标准溶液,造成一定的滴定误差。因此在滴定氯化物时,为了避免上述沉淀转化反应的发生,可以采取下列措施之一:
①将已生成的AgCl沉淀滤去,再用NH 4 SCN标准溶液滴定滤液。但这一方法需要滤过洗涤等操作,手续烦琐。
②在用NH 4 SCN标准溶液滴定前,向待测Cl - 的溶液中加入一定量有机溶剂如硝基苯、二甲酯类等,强烈振摇后,有机溶剂将AgCl沉淀包住,使它与溶液隔开,这就阻止了SCN - 与AgCl发生沉淀转化反应。
③提高Fe 3+ 的浓度以减小终点时SCN - 的浓度,从而减小滴定误差。实验证明,当溶液中Fe 3+ 浓度为0.2mol/L时,滴定误差将小于0.1%。
应用此法测定Br - 、I - 时,由于AgBr和AgI的溶度积常数都比AgSCN小,所以不存在沉淀的转化。但在滴定碘化物时,指示剂必须在加入过量AgNO 3 溶液之后才能加入,以免发生下述反应而造成误差:
2I - +2Fe 3+ ══I 2 +2Fe 2+
滴定应在HNO 3 溶液中进行,一般控制溶液酸度在0.1~1mol/L之间。若酸度较低,则因Fe 3+ 水解形成颜色较深的 [Fe(H 2 O) 5 OH] 2+ 或 [Fe(H 2 O) 4 (OH) 2 ] 4+ 等影响终点的观察,甚至产生Fe(OH) 3 沉淀以致失去指示剂的作用。
采用直接滴定法可测定Ag + 等;采用返滴定法可测定Cl - 、Br - 、I - 、SCN - 等离子。
吸附指示剂法是以吸附指示剂确定滴定终点的一种银量法。
现以AgNO 3 标准溶液滴定Cl - 为例,说明指示剂荧光黄的作用原理。吸附指示剂是一类有机染料,用HFIn表示,在水溶液中可离解为荧光黄阴离子FIn - ,呈黄绿色,在溶液中易被带正电荷的胶状沉淀吸附,会因吸附后结构的改变引起颜色的变化,从而指示滴定终点。吸附指示剂可分为两类:①酸性染料,如荧光黄及其衍生物,它们是有机弱酸,离解出指示剂阴离子;②碱性染料,如甲基紫、罗丹明6G等,离解出指示剂阳离子。例如用AgNO 3 标准溶液滴定Cl - 时,可采用荧光黄作指示剂。荧光黄是一种有机弱酸,用HFIn表示,在溶液中存在如下离解平衡:
HFI
 FIn
-
(黄绿色)+H
+
p
K
a
=7
FIn
-
(黄绿色)+H
+
p
K
a
=7
在化学计量点之前,生成的AgCl沉淀在过量的Cl - 溶液中,吸附Cl - 而带负电荷,形成的(AgCl)·Cl - 不吸附指示剂阴离子FIn - ,溶液呈现FIn - 的黄绿色。达化学计量点时,微过量的AgNO 3 可使AgCl沉淀吸附Ag + 形成(AgCl)·Ag + 而带正电荷,此带正电荷的(AgCl·Ag + )吸附荧光黄阴离子FIn - ,结构发生变化呈现粉红色,使整个溶液由黄绿色变成粉红色,指示终点的到达。
此过程可示意如下:
终点前Cl - 过量:AgCl·Cl - + FIn - (黄绿色)
终点后Ag + 过量:AgCl·Ag + +FIn - =AgCl·Ag + ·FIn - (粉红色)
如果用NaCl滴定Ag + ,则颜色的变化正好相反。
1.由于吸附指示剂的颜色变化发生在沉淀微粒表面上,因此,欲使终点变色明显,应尽可能使卤化银沉淀呈胶体状态,使沉淀的比表面积大一些。为此常加入一些保护胶体如糊精或淀粉等高分子化合物作为保护剂,阻止卤化银凝聚,使其保持胶体状态。
2.溶液的酸度要适当:常用的吸附指示剂大多是有机弱酸,而起指示剂作用的是它们的阴离子。溶液的酸度必须有利于指示剂的显色离子存在。例如荧光黄其p K a =7,适用于pH值7.0~10的条件下进行滴定,只能在pH值7.0~10的中性或弱碱性溶液中使用。若pH<7,则主要以HFIn形式存在,H + 与指示剂阴离子结合成不被吸附的指示剂分子,它不被沉淀吸附,无法指示终点。二氯荧光黄其p K a =4,可以在pH值4~10范围内使用。曙红的酸性更强(p K a ≈2),即使pH低至2,也能指示终点。甲基紫为阳离子指示剂,它必须在pH值1.5~3.5的酸性溶液中使用。
3.胶体颗粒对指示剂的吸附能力应略小于对被测离子的吸附能力,否则指示剂将在化学计量点前变色。但也不能太小,否则终点出现过迟。
卤化银对卤化物和几种常见吸附指示剂的吸附能力的次序如下:
I - >二甲基二碘荧光黄>Br - >曙红>Cl - >荧光黄
因此,滴定Cl - 时只能选用荧光黄,滴定Br - 时选用曙红为指示剂。
4.滴定应避免在强光下进行,因为吸附着指示剂的卤化银胶体对光极为敏感,遇光易分解析出金属银,溶液很快变灰色或黑色。
吸附指示剂法可用于Cl
-
、Br
-
、I
-
、SCN
-
、
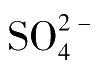 和Ag
+
等离子的测定。常用的吸附指示剂及其适用范围和条件列于表5-1。
和Ag
+
等离子的测定。常用的吸附指示剂及其适用范围和条件列于表5-1。
表5-1 常用的吸附指示剂及应用范围
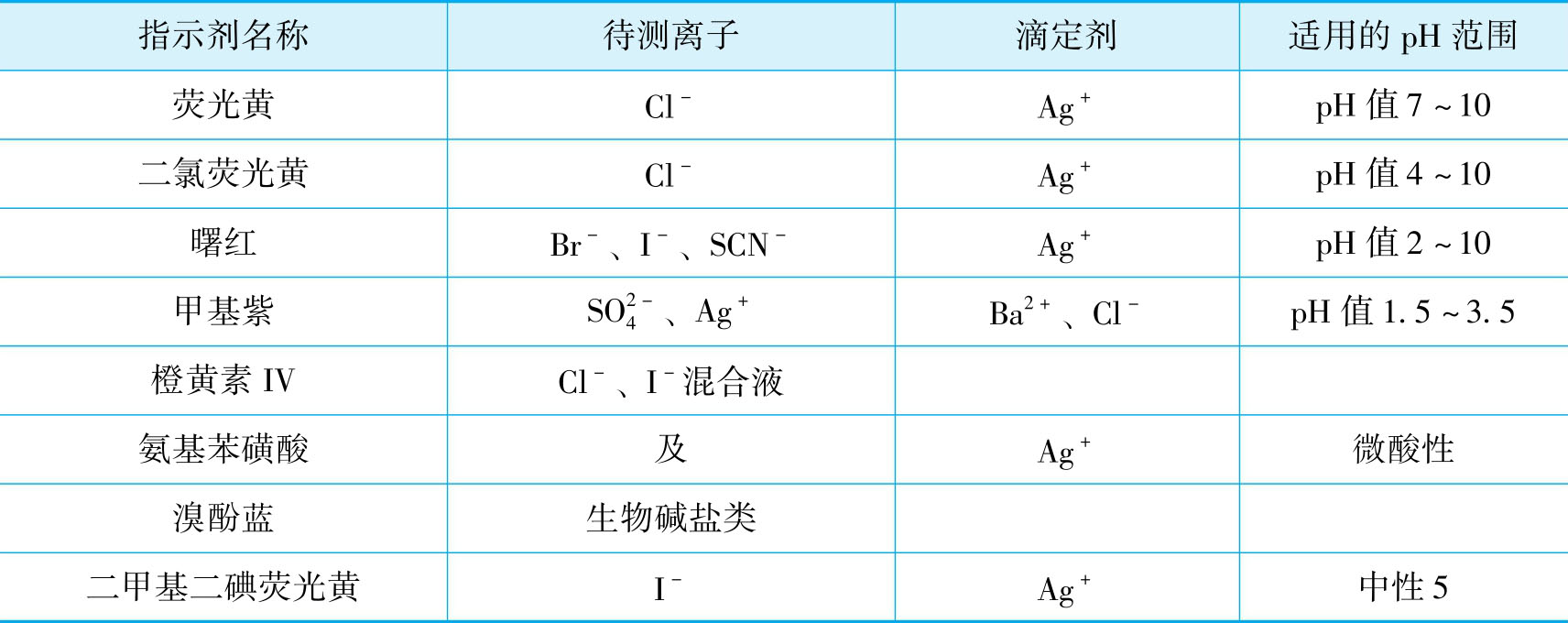
无机卤化物如NaCl、 CaCl 2 、 NH 4 Cl、 NaBr、 KBr、 NH 4 Br、 KI、 NaI等,以及许多有机碱的氢卤酸盐如盐酸麻黄碱,均可用银量法测定。
例:盐酸麻黄碱片的含量测定
盐酸麻黄碱的化学式为C 10 H 16 NOCl。
精密称取15片(每片含盐酸麻黄碱25mg或30mg,用 m C10H16NOCl 表示),求出平均片重(用 m AVG 表示)。研细,精密称取适量(用 m s 表示,约相当于盐酸麻黄碱0.15g)置锥形瓶中,加纯化水15mL使其溶解,加溴酚蓝指示剂2滴,滴加醋酸使溶液由紫色变成黄绿色,再加溴酚蓝指示剂10滴与1→50糊精溶液5mL,用0.1mol/L硝酸银滴定液滴定至混浊液呈灰紫色,即为终点。
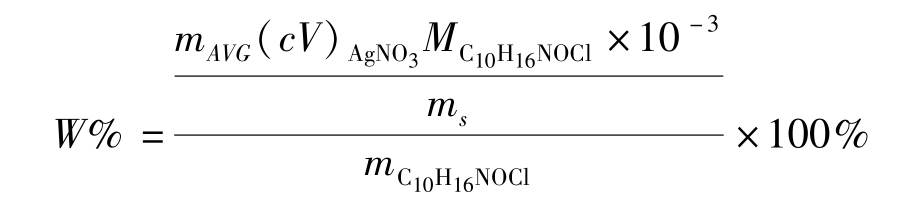
式中 W %为含量占标示量的百分数。
由于有机卤化物中卤素原子与碳原子结合的比较牢固,必须经过适当的预处理,使有机卤化物中的卤素原子转变为卤离子进入溶液再进行测定。通常采用下列三种预处理方法。
1.NaOH水解法 常用于脂肪族卤化物或卤素结合在芳香环侧链上类似脂肪族卤化物的有机化合物的测定。测定方法如下:
将样品与NaOH水溶液加热回流煮沸水解,有机卤素就以X - 的形式转入溶液中,待溶液冷却后,用稀HNO 3 酸化,再用铁铵矾指示剂法测定其释放出来的X - 。其水解反应可表示为:
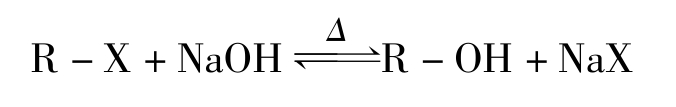
2.氧瓶燃烧法 常用于结合在苯环或杂环上的有机卤素化合物的测定。测定方法如下:
将样品包入滤纸内,夹在燃烧瓶的铂丝下部,瓶内加入适量的吸收液(NaOH、H 2 O或二者的混合液)。然后充入氧气,点燃,待燃烧完全后,充分振摇至瓶内白色烟雾完全吸收为止,再用银量法测定含量。有机氯化物和溴化物都可以采用本法测定。
3.Na 2 CO 3 熔融法 常用于结合在苯环或杂环上的有机卤素化合物的测定。测定方法如下:
将样品与无水Na 2 CO 3 置于坩埚内,混合均匀,灼烧至完全灰化,冷却,加纯化水溶解,加稀硝酸酸化,用银量法测定。
1.学习银量法测定氯的原理和方法。
2.掌握沉淀滴定法的基本操作技术。
中性或弱碱性溶液中,以K 2 CrO 4 为指示剂,用AgNO 3 标准溶液滴定氯化物。
AgCl的溶解度<Ag
2
CrO
4
的溶解度,因此溶液中首先析出AgCl沉淀,当达到终点后,过量的AgNO
3
与
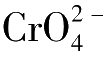 生成砖红色沉淀。
生成砖红色沉淀。
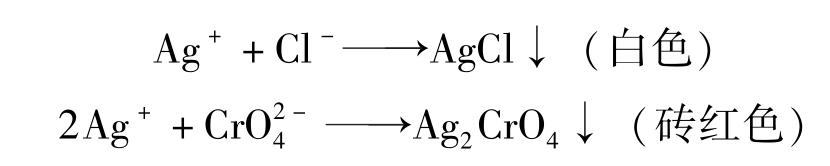
1.仪器 烧杯、电子分析天平、容量瓶(100mL)、坩埚、煤气灯、锥形瓶(250mL)、酸式滴定管(50mL)、 移液管(25mL)。
2.试剂 0.1mol/L AgNO 3 标准溶液、NaCl标准溶液、K 2 CrO 4 (5%)溶液、生理盐水样品。
AgNO 3 标准溶液可直接用分析纯的AgNO 3 结晶配制,但由于AgNO 3 不稳定,见光易分解,故若要精确测定,要用NaCl基准物质来标定。
1.直接配制 在一小烧杯中精确称量1.7g左右的AgNO 3 ,加适量水溶解后,定量转移到100mL容量瓶中,用水稀释至刻度,摇匀,计算其准确度。
2.间接配制 将NaCl置于坩埚中,用煤气灯加热至500~600℃干燥后,冷却,放置在干燥器中冷却备用。
用台秤称量1.7g的AgNO 3 ,定量转移到100mL容量瓶中,用水稀释至刻度,摇匀。
标定:准确称取0.15~0.2g的NaCl三份,分别置于三个锥形瓶中,各加25mL水使其溶解。加1mL K 2 CrO 4 溶液,在充分摇动下,用AgNO 3 溶液滴定至溶液刚出现稳定的砖红色,记录AgNO 3 溶液的用量,计算AgNO 3 溶液的浓度。
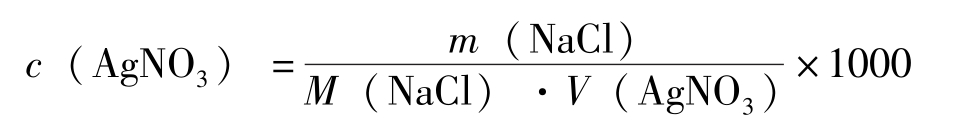
平行滴定三次,计算AgNO 3 溶液的浓度。
将生理盐水稀释1倍后,用移液管精确移取已稀释的生理盐水25.00mL置于锥形瓶中,加入1mL K 2 CrO 4 指示剂,用标准AgNO 3 溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。平行滴定三次,计算NaCl的含量。
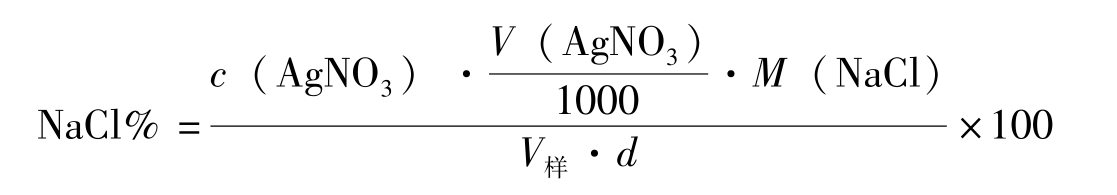
平行测定3次。计算氯化钠的含量和3次结果的相对平均偏差。
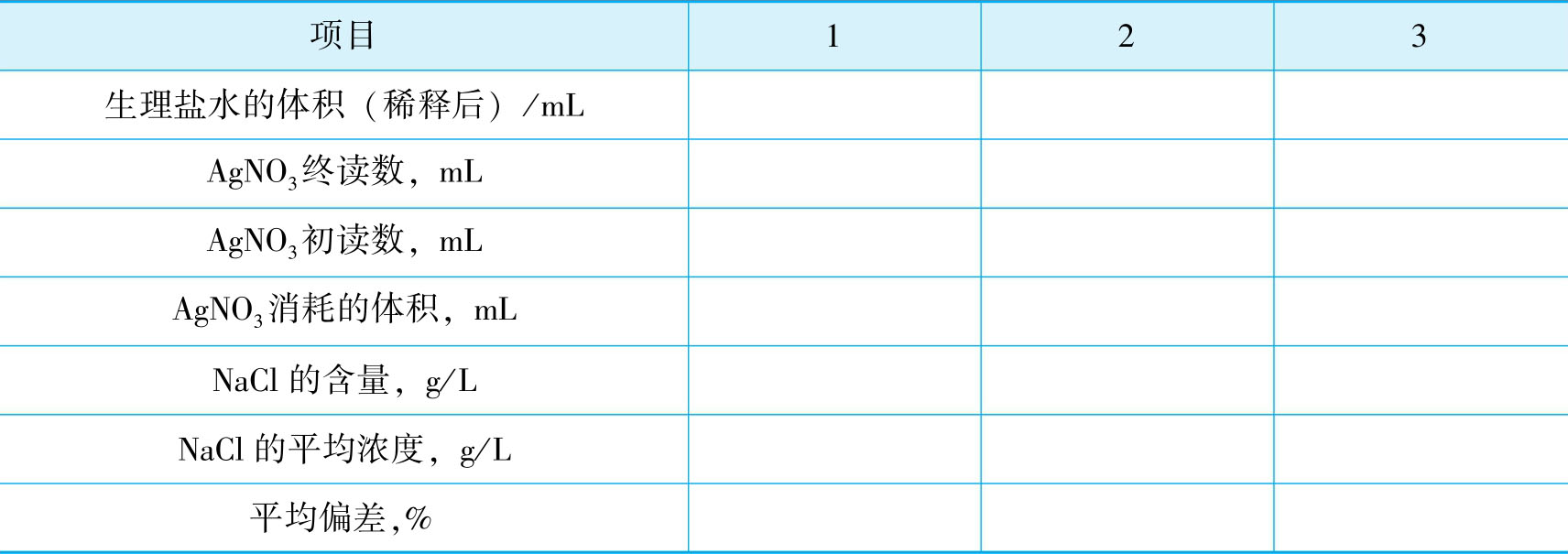
1.将实验记录和结果数据记录在下列表格中。
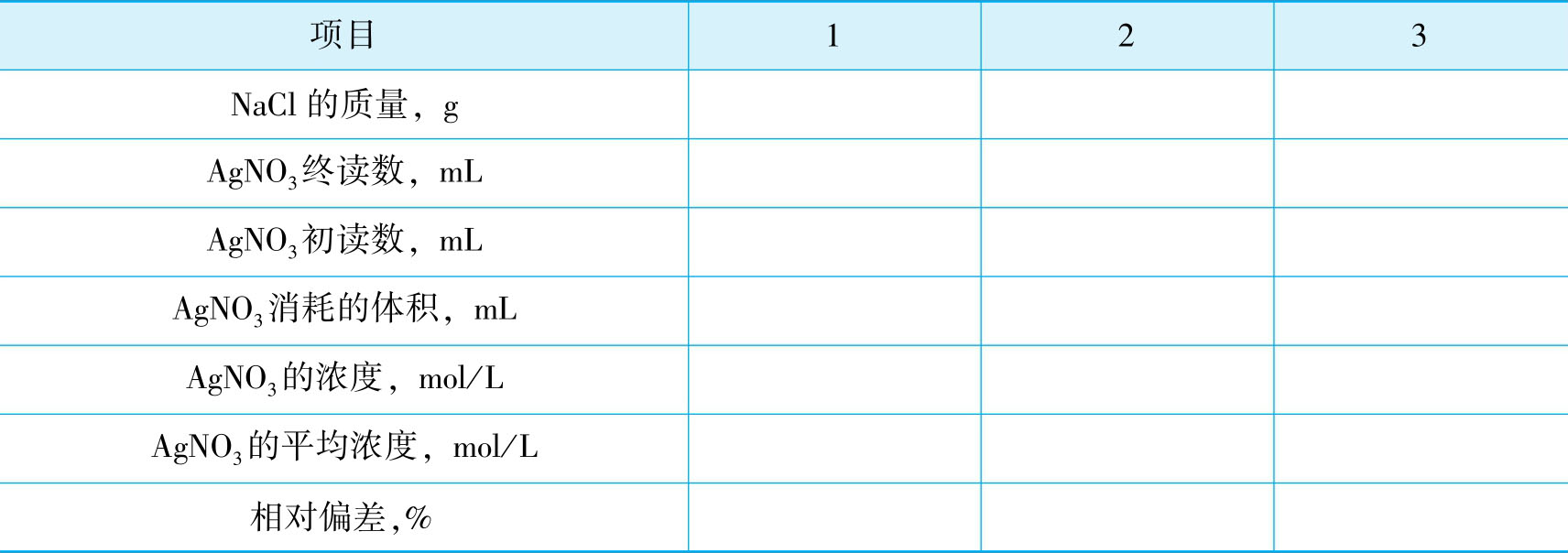
2.生理盐水中NaCl的含量测定的数据记录表。
1.K 2 CrO 4 指示剂浓度的大小对Cl - 测定有何影响?
2.滴定液的酸度应控制在什么范围为宜?为什么?若有NH + 4 存在时,对溶液的酸度范围的要求有什么不同?
3.铬酸钾指示剂法(莫尔法)测定酸性氯化物溶液中的氯,事先应采取什么措施?
4.本实验可不可以用荧光黄代替K 2 CrO 4 作指示剂?为什么?
铬酸钾指示剂法、铁铵矾指示剂法和吸附指示剂法的测定原理、应用比较如下:
复习思考
一、选择题
1.下列叙述中,正确的是( )
A.由于AgCl水溶液的导电性很弱,所以它是弱电解质
B.难溶电解质溶液中离子浓度的乘积就是该物质的溶度积
C.溶度积大者,其溶解度就大
D.用水稀释含有AgCl固体的溶液时,AgCl的溶度积不变,其溶解度也不变
2.下列叙述中正确的是( )
A.混合离子的溶液中,能形成溶度积小的沉淀者一定先沉淀
B.某离子沉淀完全,是指其完全变成了沉淀
C.凡溶度积大的沉淀一定能转化成溶度积小的沉淀
D.当溶液中有关物质的离子积小于其溶度积时,该物质就会溶解
3.NaCl是易溶于水的强电解质,但将浓盐酸加到它的饱和溶液中时也会析出沉淀,对此现象的正确解释应是( )
A.由于Cl - 浓度增加,使溶液中 c (Na + )· c (Cl - )> K sp(NaCl),故NaCl沉淀出来
B.盐酸是强酸,故能使NaCl沉淀析出
C.由于 c (Cl - )增加,使NaCl的溶解平衡向析出NaCl方向移动,故有NaCl沉淀析出
D.酸的存在降低了盐的溶度积常数
4.NaCl滴定AgNO 3 (pH=2.0)的指示剂为( )
A.K 2 CrO 4 B.二氯荧光黄(p K a =4.0)
C.(NH 4 ) 2 SO 4 ·Fe 2 (SO 4 ) 3 D. 曙红(p K a =2.0)
5.吸附指示剂法中应用的指示剂其性质属于( )
A.配位 B.沉淀 C.酸碱 D.吸附
6.用摩尔法测定时,干扰测定的阴离子是( )

7.用摩尔法测定时,阳离子( )不能存在。
A.K + B.Na + C.Ba 2+ D.Mg 2+
二、简答题
1.银量法根据确定终点所用指示剂的不同可分为哪几种方法?它们分别用的指示剂是什么?又是如何指示滴定终点的?
2.试讨论摩尔法的局限性。
3.用银量法测定下列试样中Cl - 含量时,选用哪种指示剂指示终点较为合适?
(1)BaCl 2 (2)NaCl+Na 3 PO 4 (3)FeCl 2 (4)NaCl+Na 2 SO 4
4.什么叫沉淀滴定法?沉淀滴定法所用的沉淀反应必须具备哪些条件?
5.写出铬酸钾指示剂法、铁铵矾指示剂法和吸附指示剂法测定Cl - 的主要反应,并指出各种方法选用的指示剂和酸度条件。
6.用银量法测定下列试样: (1)BaCl 2 (2)KCl(3)NH 4 Cl(4)KSCN(5)NaCO 3 +NaCl(6)NaBr,各应选用何种方法确定终点?为什么?
7.在下列情况下,测定结果是偏高、偏低,还是无影响?并说明其原因。
(1)在pH=4的条件下,用铬酸钾指示剂法测定Cl - ;
(2)用铁铵矾指示剂法测定Cl - ,既没有将AgCl沉淀滤去或加热促其凝聚,又没有加有机溶剂;
(3)同(2)的条件下测定Br - ;
(4)用吸附指示剂法测定Cl - ,曙红作指示剂;
(5)用吸附指示剂法测定I - ,曙红作指示剂。
三、计算题
1.用铁铵矾指示剂法测定0.1mol/L的Cl - ,在AgCl沉淀存在下,用0.1mol/L KSCN标准溶液回滴过量的0.1mol/L AgNO 3 溶液,滴定的最终体积为70mL,[Fe 3+ ]=0.015mol/L。当观察到明显的终点时,([FeSCN 2+ ]=6.0×10 -6 mol/L),由于沉淀转化而多消耗KSCN标准溶液的体积是多少? [已知 K sp(AgCl) =1.8 × 10 -10 , K sp(AgSCN) =10 × 10 -12 , K (FeSCN) =200]
2.称取NaCl基准试剂0.1773g,溶解后加入30.00mL AgNO 3 标准溶液,过量的Ag + 需要3.20mL NH 4 SCN标准溶液滴定至终点。已知20.00mL AgNO 3 标准溶液与21.00mL NH 4 SCN标准溶液能完全作用,计算AgNO 3 和NH 4 SCN溶液的浓度各为多少?(已知 M NaCl =58.44)
3.Ag 2 CrO 4 沉淀在(1)0.0010mol/L AgNo 3 溶液中,(2)0.0010mol/L K 2 CrO 4 溶液中,溶解度何者为大?
4.计算沉淀CaC 2 O 4 在(1)纯水;(2)pH值4.0酸性溶液的溶解度。(已知CaC 2 O 4 的 K sp =2.0 ×10 -9 ,H 2 C 2 O 4 的 K a1 =5.9×10 -2 , K a2 =6.4 ×10 -5 )
5.量取NaCl试液20.00mL,加入K 2 CrO 4 指示剂,用0.1023mol/L AgNO 3 标准溶液滴定,用去27.00mL,求每升溶液中含NaCl多少克?
6.称取可溶性氯化物试样0.2266g用水溶解后,加入0.1121mol/L AgNO 3 标准溶液30.00mL。过量的Ag + 用0.1185mol/L NH 4 SCN标准溶液滴定,用去6.50mL,计算试样中氯的质量分数。