




【学习目标】
掌握系统误差、偶然误差的概念;准确度与精密度的表示方法及关系;提高准确度的方法;有效数字的记录、修约及运算。
熟悉分析结果表示方法。
了解可疑值的取舍。
引 子
定量分析的目的是准确测定试样中某物质的含量,因此要求结果必须准确可靠。但在实际工作中,由于受到所采用的分析方法、仪器、试剂、工作环境和分析工作者自身等因素的制约,使得测量值与真实值不可能完全一致,这是因为客观上存在着难以避免的误差。误差可能出现在测量的各个步骤,从而影响分析结果的准确度。随着科学技术的进步和人类认识客观世界能力的提高,误差可以被尽量地减小以提高准确度,但难以降至为零。因此,有必要讨论误差产生的原因和减免误差的方法。另外,由于误差的客观存在,必须对分析结果的可靠性进行合理评价,并给予正确表达。
定量分析过程一般包括下列几个步骤:
1.分析任务和计划的确定 首先要根据需要解决的问题进行实验方案设计,包括分析方法的选择、仪器和试剂的选择、实验条件的规划等。因为各种分析方法各有其特点和局限性,在实际工作中应根据被测物的性质、含量、试样的组成和对分析结果准确度的要求等具体情况来确定。
2.取样 取样是指从大量的分析对象中抽取一小部分作为分析材料的过程,所取得的分析材料称为试样或样品。它是定量分析的一个重要步骤,要求样品的组成必须均匀,具有代表性,能代表全部分析对象的平均组成,否则分析结果做得再准确也毫无意义。在进行分析之前,应根据分析对象的性质、均匀程度、数量和分析项目来确定具体取样方法和取样数量。
3.试样的制备 试样制备的目的是使试样适合于选定的分析方法,消除可能的干扰。根据试样的性质,试样制备包括干燥、粉碎、研磨、溶解、滤过、提取、分离、富集(浓缩)等步骤。
4.分析测定 根据已选定的分析方法,优化测定条件,确保所用试剂纯度和所用测量仪器、器皿的精度满足测定要求,通常可通过空白试验消除试剂误差,通过仪器校正减免仪器误差,通过加掩蔽剂排除干扰组分的干扰。
5.结果的处理和表达 通过计算求出被测组分含量,并正确表达分析结果。
在分析工作中产生误差的原因很多,根据误差产生的原因和性质,可将误差分为系统误差和偶然误差。
系统误差也称可定误差,它是定量分析误差的主要来源,对测定结果的准确度有较大影响。系统误差是由分析过程中某些确定的原因造成的,因此对分析结果的影响比较固定。系统误差具有重现性、单向性和可测性的特点,其数值大小也有一定的规律。如果能找出产生误差的原因就可以减小系统误差。根据系统误差产生的原因,可将其分为以下四类。
1.仪器误差 由于所用仪器本身不够准确或未经校准所引起的误差。如砝码腐蚀生锈;容量瓶、移液管、滴定管等容量仪器的刻度不够准确等。
2.试剂误差 由于试剂纯度不够或蒸馏水中含有微量杂质而引起的误差。如使用的试剂中含有微量的被测组分或存在干扰杂质等。
3.操作误差 主要指在正常操作情况下,由于操作者的实际操作和正确操作规程稍有出入所造成的误差。例如,滴定管读数偏高或偏低;对终点颜色的确定偏深或偏浅;对某种颜色的辨别不够敏锐等造成的误差。
4.方法误差 由于分析方法本身不完善或有缺陷所引起的误差。例如,由于反应条件不完善而导致化学反应进行不完全;反应副产物的产生;滴定分析中滴定终点与化学计量点不完全相符等,都会使测定结果偏高或偏低而产生系统误差。
偶然误差又称为不可定误差,在相同的条件下,在消除了系统误差之后,对同一试样多次进行测量,每次测量所得结果仍然会出现一些无规律的随机性变化,这种随机性变化的误差称为随机误差或偶然误差。偶然误差是由某些难以控制或无法避免的偶然因素造成的。如测量时温度、湿度、气压的微小变化,分析仪器的轻微波动及分析人员操作的细小变化等,都可能引起测量数据的波动而带来偶然误差。
偶然误差的大小、正负都不固定,有时大,有时小;有时正,有时负,是较难预测和控制的。但是,如果在相同的条件下对同一样品进行多次测定,并将测定数据进行统计处理,则可发现偶然误差存在着一定规律性:绝对值相同的正负误差出现的概率相等,小误差出现的概率大,大误差出现的概率小,特别大的误差出现的概率极小,这一规律称为偶然误差的正态分布规律,见图2-1。在消除系统误差的前提下,随着测定次数的增加,偶然误差的算术平均值趋近于零。所以,可以通过“平行多次测定,取平均值”的方法来消除偶然误差。一般平行测定3~4次即可达到不超过偶然误差规定的范围。
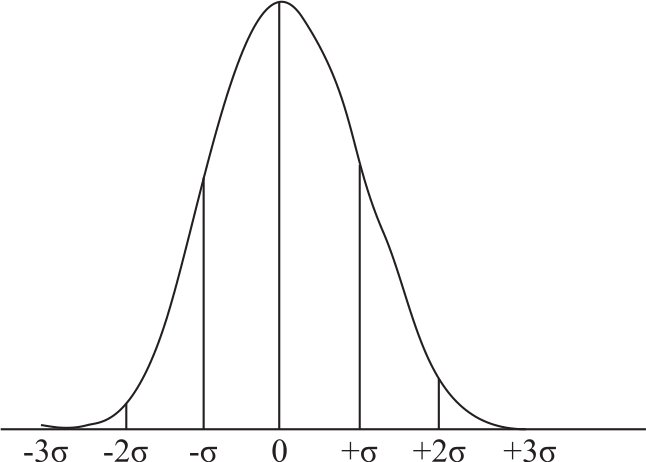
图2-1 偶然误差的正态分布曲线
另外,由于分析人员粗心大意或工作过失所产生的差错,例如溶液溅失、加错试剂、读错刻度、加错砝码、记录和计算错误等,这些不属于误差范畴,应舍弃此数据。分析人员应加强工作责任心,严格遵守操作规程,做好原始记录,反复核对,避免这类错误的发生。
准确度(accuracy)是指测量值与真实值( μ )接近的程度。准确度的高低通常用误差(error)来表示,误差越小,表示分析结果与真实值越接近,准确度越高。相反,误差越大,表示准确度越低。
误差又分为绝对误差和相对误差,其表示方法如下:
绝对误差( E )=测量值( x )-真实值( μ )(2-1)
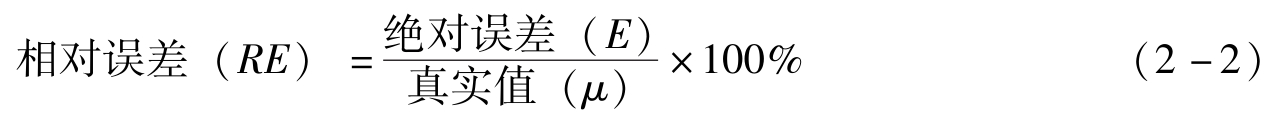
例2-1 用万分之一分析天平称量某样品两份,其质量分别为2.8653g和0.2876g。如果两份样品的真实质量分别为2.8652g和0.2875g,分别计算两份样品称量的绝对误差和相对误差。
解:两份样品称量的绝对误差分别为:
E 1 = x 1 - μ 1 =2.8653-2.8652=0.0001g
E 2 = x 2 - μ 2 =0.2876-0.2875=0.0001g
两份样品称量的相对误差分别为:
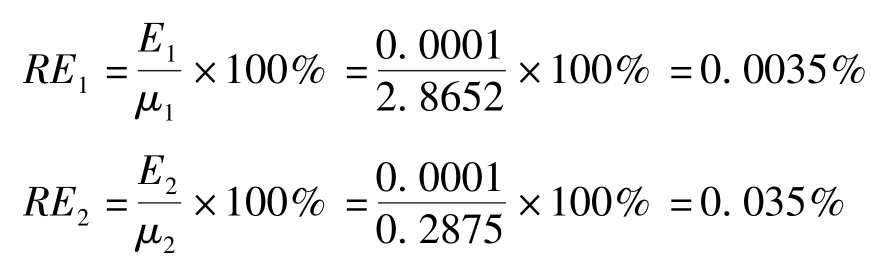
由上述计算可以看出,两份样品称量的绝对误差相等,但相对误差不同,后者比前者大得多。因此,相对误差更能体现出测定结果的准确度,在分析工作中,通常用相对误差来表示准确度。并且当称量质量较大时,相对误差较小,准确度更高。反之,称量的质量较小时,相对误差较大,准确度更低。绝对误差和相对误差都有正值、负值,正值表示分析结果偏高,负值表示分析结果偏低。
精密度(precision)是指在相同条件下多次测量结果的相互接近的程度。精密度反映了测量结果的重现性,用偏差(deviation)表示,其数值越小,表明各测量结果之间越接近,精密度越高;反之,精密度越低。因此,偏差的大小是衡量测量结果精密度高低的尺度。
偏差又分为绝对偏差、平均偏差、相对平均偏差、标准偏差和相对标准偏差。具体表示方法如下:
1.绝对偏差(
d
)
单个测量值(
x
i
)与测量平均值(
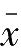 )之差称为绝对偏差,表示如下:
)之差称为绝对偏差,表示如下:

绝对偏差值有正有负。
2.平均偏差(
 )
各单个绝对偏差绝对值的平均值称为平均偏差,表示如下:
)
各单个绝对偏差绝对值的平均值称为平均偏差,表示如下:
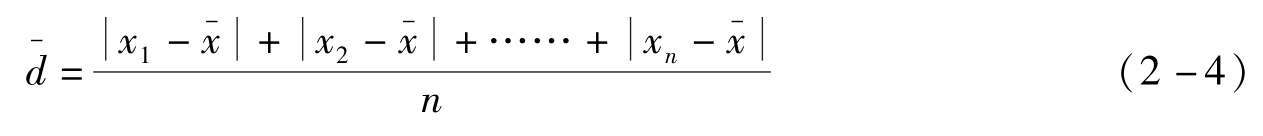
平均偏差肯定为正值,式中n为测量次数。
3.相对平均偏差(
 )
平均偏差
)
平均偏差
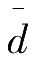 与测量平均值
与测量平均值
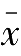 的比值称为相对平均偏差,表示如下:
的比值称为相对平均偏差,表示如下:

在滴定分析中,分析结果的相对平均偏差一般应小于0.2%。使用相对平均偏差表示精密度比较简单、方便,但不能反映一组数据的波动情况,即分散程度。因此对要求较高的分析结果常采用标准偏差来表示精密度。
4.标准偏差( S ) 在一系列测量值中,偏差小的值总是占多数,这样在平均偏差和相对平均偏差的计算过程中,忽略了个别较大偏差对测定结果重现性的影响,而采用标准偏差则是为了突出较大偏差的影响,它比平均偏差更能说明数据的分散程度。对少量测定值( n ≤20)而言,其标准偏差的定义式如下:

例如,有A、B两组数据,各次测量的绝对偏差分别为:
A 组:+0.3,-0.2,-0.4,+0.2,+0.1,+0.4,-0.3,+0.2,-0.3
B 组:0.0,+0.1,-0.7,+0.1,-0.1,-0.2,+0.9,+0.1,-0.2
从上述两组数据可以看出,B组中有两个较大的偏差(-0.7和+0.9),明显比A组数据更分散,精密度更差。但两组数据的平均偏差相同(都是0.24),没有体现出精密度的差异。这时,如果用标准偏差就能分辨出这两组数据精密程度,它们的标准偏差分别为0.28和0.40,可见,A组数据精密度更好。
5.相对标准偏差(
RSD
)
标准偏差
S
与测量平均值
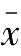 的比值称为相对标准偏差,表示如下:
的比值称为相对标准偏差,表示如下:

在实际工作中常用相对标准偏差 RSD 表示分析结果的精密度。
例2-2 测定某HCl溶液的浓度,平行测定四次,测定结果分别为0.1021mol·L -1 、0.1025mol·L -1 、0.1029mol·L -1 和0.1023mol·L -1 ,计算测定结果的平均值、平均偏差、相对平均偏差、标准偏差和相对标准偏差。
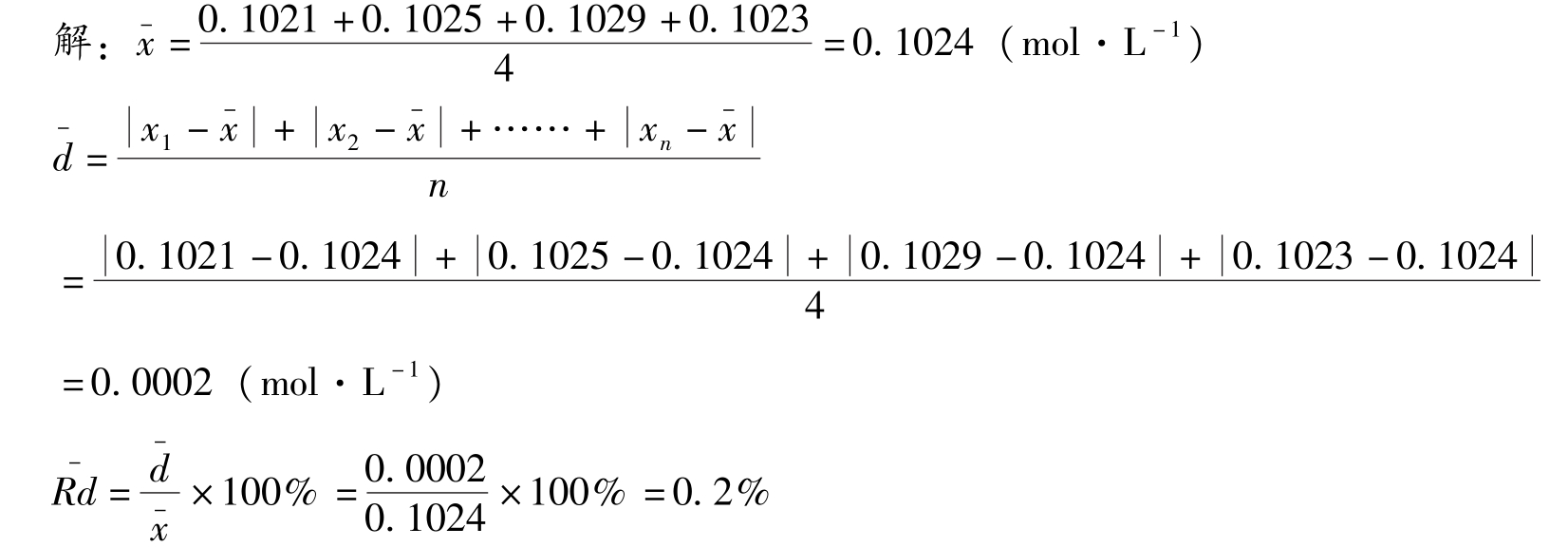
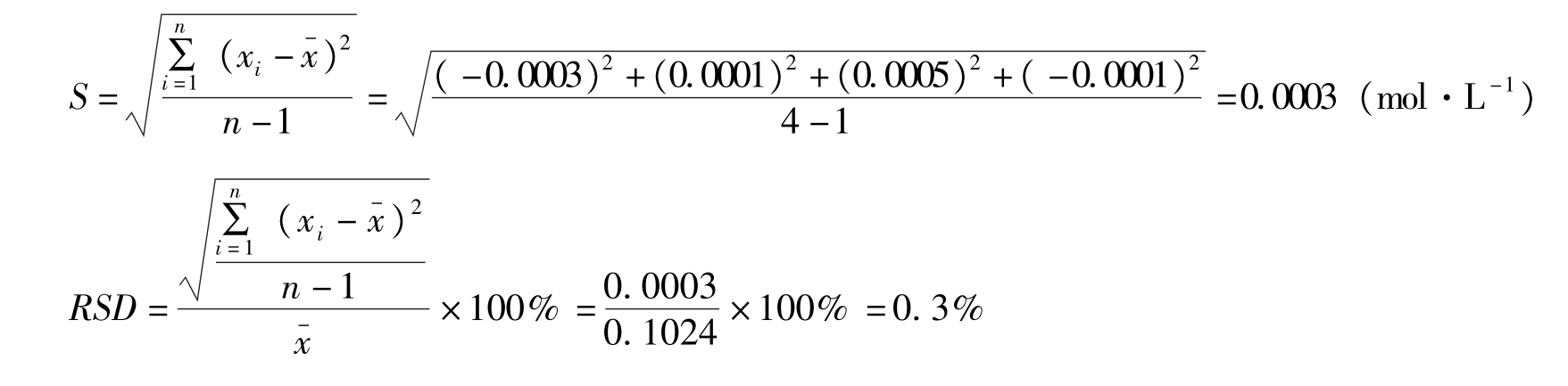
知识链接
重复性、中间精密度与重现性均用于反映测量结果的精密度,但三者的概念不同。重复性是指相同操作条件下,在较短的时间间隔内,由同一分析人员对同一试样测定结果的接近程度;中间精密度是指在同一实验室内,改变某些实验条件(如分析人员、仪器设备等),对同一试样测定结果的接近程度;重现性是指在不同的实验室之间,由不同的分析人员对同一试样测定结果的接近程度。
准确度表示测量结果的正确性;精密度表示测量结果的重复性或重现性。当有真实值作比较时,它们从不同侧面反映了分析结果的可靠性。系统误差是定量分析中误差的主要来源,它影响分析结果的准确度;偶然误差影响分析结果的精密度。测定结果的好坏应从精密度和准确度两个方面衡量。
图2-2表示A、B、C、D四人同时测定同一试样中某组分含量时所得的结果。每人各平行测定4次,试样的真实含量为32.50%。A的测定值之间相差很小,因此它的精密度高,偶然误差很小,而且平均值与真实值也接近,因此它的准确度也高,测定结果可靠;B测得的数据精密度高但准确度差,说明偶然误差很小但系统误差大,测量结果不可靠;C的准确度与精密度都很差,结果不可靠;D的平均值虽然接近真实值,但几个数据彼此相差很远,仅是由于正负误差相互抵消才使结果接近真实值,纯属巧合,不可靠。
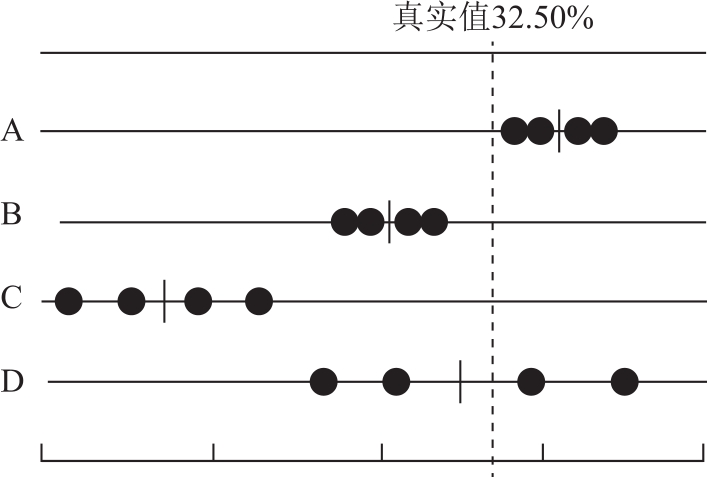
图2-2 定量分析中准确度与精密度的关系
由此可见,精密度高,准确度不一定高,因为可能存在较大的系统误差。但准确度高一定要求精密度好,若精密度差,说明偶然误差大,测定结果不可靠。即精密度高是准确度高的前提,只有精密度与准确度都高的测量值才是可信的。
为了提高分析结果的准确度,必须尽量减小分析过程中的系统误差和偶然误差。下面介绍几种减小误差的主要方法。
不同分析方法具有不同的灵敏度和准确度。化学分析法对于常量组分的测定能获得比较理想的分析结果,其相对误差一般能控制在0.2%以内。但化学分析法灵敏度不高,不能准确测定微量或痕量组分。仪器分析法灵敏度高、绝对误差小,能满足微量或痕量组分测定准确度的要求,但是其相对误差较大,不适合于常量组分的测定。因此常量组分的测定一般应选用化学分析法,微量或痕量组分的测定应选用仪器分析法。另外,选择分析方法时,还应考虑共存组分的干扰等各种因素。因此,应根据分析对象、样品情况及对分析结果的要求选择合理的分析方法。
为保证分析结果的准确度,应尽量减小测量误差。
在称量固体试样时,为了减小称量的相对误差,可适当增大样品的称量质量。一般分析天平称量的绝对误差为±0.0001g,用减重称量法称量一份试样需要称量两次,可能引起的最大绝对误差是±0.0002g。如使用万分之一的分析天平分别称取0.02g、0.1g、0.2g试样,三次称量的称量误差分别如下:
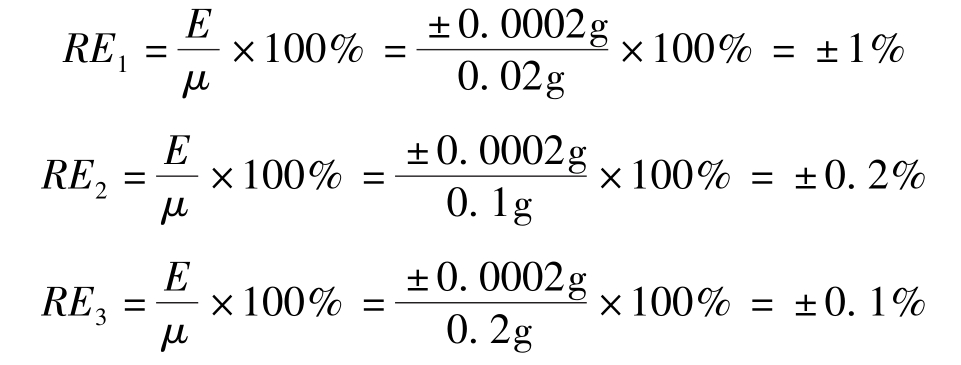
在消除系统误差的前提下,因为偶然误差的随机性(有正、有负),可通过平行测定多次取平均值的方法抵消掉部分偶然误差,以达到减小偶然误差的目的。平行测定次数越多,所得结果的平均值越接近于真实值。通常在实际工作中,一般对同一试样平行测定3~5次即可。当分析结果的准确度要求较高时,需适当增加平行测定的次数,通常在10次左右。增加测定的次数过多,费时费事,效果却不太明显,得不偿失,所以在实际工作中只要精密度达到要求即可。
1.校准仪器 系统误差中的仪器误差可以通过校准仪器来减小。例如砝码、滴定管、移液管、容量瓶等,必须进行校准,并在计算结果时采用校正值。由于计量及测量仪器的状态会随时间、环境等条件发生变化,因此需要定期进行校准。
2.空白试验 在不加入试样的情况下,按照与测定试样相同的方法、条件、步骤进行的分析试验,称为空白试验。所得结果称为空白值。从试样的分析结果中扣除掉空白值,可以消除由于试剂、蒸馏水、实验器皿等引入的杂质所造成的系统误差,使测量值更接近于真实值。空白值一般很小,否则应通过提纯试剂或改用其他器皿等方法减小系统误差。
3.对照试验 用已知溶液代替样品溶液,在相同条件下进行测定,这种分析试验称为对照试验。用以检查试剂是否失效、反应条件是否正常、测量方法是否可靠。对照试验是检查系统误差的有效方法。常用的有标准试样对照法和标准方法对照法。
标准试样对照法是用已知准确含量的试样代替待测试样,在完全相同的条件下进行分析,以此对照。
标准方法对照法是用公认的经典分析法或国家颁布的标准分析方法与被检验的分析方法,对同一试样进行分析对照。若测定结果很接近,则说明被检验的方法可靠。
4.回收试验 如果无标准试样做对照试验,或对试样的组成不太清楚时,可做回收试验。在几份相同的试样( n ≥5)中,加入适量待测组分的纯品,以相同的条件进行测定,按下式计算回收率:

回收率越接近100%,系统误差越小,方法准确度越高。回收试验常在微量组分分析中应用。
分析化学中的数字有两类,一类数字为非测量所得的自然数,如各类常数、测量次数、计算中的倍数、反应中化学计量关系等,这类数字无准确度问题。另一类数字是测量所得,即测量值或数据计算的结果,其数字的位数多少应与分析方法的准确度及仪器测量的精度适应,这类数字需要正确地记录和计算。因为测量值不仅仅表示了测定结果的多少,而且还反映了测定的准确程度。因此了解有效数字的意义,掌握正确的使用方法,避免随意性,是非常重要的。
有效数字是指在分析工作中能测量到的具有实际意义的数字,其位数包括所有的准确数字和最后一位可疑数字。在记录、处理测量数据和计算分析结果时,应保留几位有效数字,必须根据测量仪器、分析方法的准确程度确定。
例如,用万分之一的分析天平称量某试样的质量为1.0338g,五位有效数字。这一数字中,1.033是准确的,最后一位“8”存在误差,是可疑数字。根据所用分析天平的准确程度,该试样的实际质量应为1.0338±0.0001g。又如,记录滴定管读数为21.36mL,四位有效数字,该数据前三位是准确的,而第四位是估读值,可能有±0.01mL的误差。
在确定有效数字的位数时,数字中的“0”有双重意义。若作为普通数字使用,是有效数字;若作为定位用,不是有效数字。例如在数据0.1800g中,8后面的两个0都是有效数字,而1前面的一个0只起定位作用,不是有效数字,因此该数据为四位有效数字。
再如:
1.0003g 18.762 五位有效数字
0.1201g 81.70% 四位有效数字
0.000230g 1.75×10 -8 三位有效数字
0.0023g 0.70% 两位有效数字
0.2g 0.02% 一位有效数字
分析化学中还经常遇到pH、p K 等对数值,其有效数字的位数仅取决于小数部分数字的位数,因为其整数部分的数字只代表原值的幂次。例如,pH=12.00,即 [H + ]=1.0×10 -12 mol·L -1 ,其有效数字为两位,而不是四位。首位为8或9的数字,其有效数字的位数在运算过程中可多算一位。例如,9.23实际上只有三位有效数字,在运算过程中可视为四位有效数字。
变换单位时,有效数字的位数必须保持不变。例如,0.0076g应写成7.6mg。在整数中有时不能确定“0”是否为有效数字,如2600mL,因此常用指数形式明确其有效数字位数,写成2.60×10 3 mL。对于很小的数字,也常用指数形式表示,但要注意有效数字位数不能改变,如0.000036可写成3.6×10 -5 。
在处理数据过程中,因为测定过程各环节中所使用仪器或器皿的精度不完全一致,各个测量数据的有效数字位数可能不同。处理分析这些数据,必须按一定规则进行记录、修约及运算。这样可以避免在数据处理上改变分析测定客观的准确度,得出不合理的结论。
根据所用仪器精度的要求,记录只保留一位可疑数字的测量值。
在处理数据过程中,各测量值的有效数字的位数可能不同,在处理分析数据时,对有效数字位数较多(即误差较小)的测量值,应将多余的数字舍弃,该过程称为数字的修约,其规则如下:
1.采用“四舍六入五留双”的规则进行修约,即当被修约的数字小于或等于4时,则舍去该数字;当被修约的数字大于或等于6时,则进位;当被修约的数字等于5(5后面无数字或数字为0)时,若5前面为偶数则舍去,为奇数则进位;当被修约的数字等于5,且5后面还有不为0的数字时,一律进位。
例如,将下列测量值修约为四位有效数字:
13.0548 13.05
13.06501 13.07
13.055 13.06
13.065 13.06
13.066 13.07
2.不能分次修约,只允许对原测量值一次修约到所需位数。如将13.0548修约为四位有效数字,不能先修约为13.055,再修约成13.06,而应一次修约为13.05。
1.加减法 几个数据相加或相减时,应以小数点后位数最少的数据(绝对误差最大的数据)为依据进行修约。
例如,0.0232+18.15+1.03773,它们的和应以18.15为依据,保留到小数点后第二位。计算时,可先修约成0.02+18.15+1.04,再计算出其和为19.21。
2.乘除法 几个数相乘或相除时,应以有效数字位数最少的数据(相对误差最大的数据)为依据进行修约。
例如,0.0232×18.15×1.03773,其积的有效数字位数的保留应以0.0232三位有效数字为依据,确定其他数据的位数,修约后进行计算。
0.0232×18.2×1.04=0.439
另外,在对数运算中,所取对数的位数应和原数据的有效数字位数相等。如 [H + ]=1.0×10 -2 mol·L -1 的溶液,则pH=2.00。在表示准确度和精密度时,大多数情况下,只取一位有效数字即可,最多取两位有效数字,如 RSD =0.05%。
记录原始数据时应保留几位有效数字,应根据测量方法和测量仪器的准确程度确定。例如,用万分之一的分析天平进行称量时,称量结果必须记录到以克为单位小数点后第四位。例如,0.2500g不能写成0.25g,也不能写成0.25000g;在滴定管上读取数据时,必须记录到以毫升为单位小数点后第二位,如消耗滴定液的体积刚好为20mL时,应记录为20.00mL。
不同的分析工作对准确度的要求不同,为了达到一定的要求,必须选择适当的测量仪器和适当的试剂用量。例如,用万分之一的分析天平以减重法称取试样时,为了使称量误差小于0.1%,称取样品质量必须大于0.2g;用滴定分析法测定常量组分时,消耗滴定液的体积不能小于20mL。
分析结果的有效数字位数与分析过程的实际情况紧密相关,如仪器、器皿的精度等。如果有效数字位数过多,超过实际情况,会夸大准确度,使测定结果不可靠;如果有效数字位数过少,则会降低测定结果的准确度。
例如,甲、乙两人用同样方法同时测定样品中某组分的含量,均用减重称量法称取样品0.3000g,甲的分析结果为55.200%,乙的分析结果为55.20%,试问哪个分析结果表示正确?
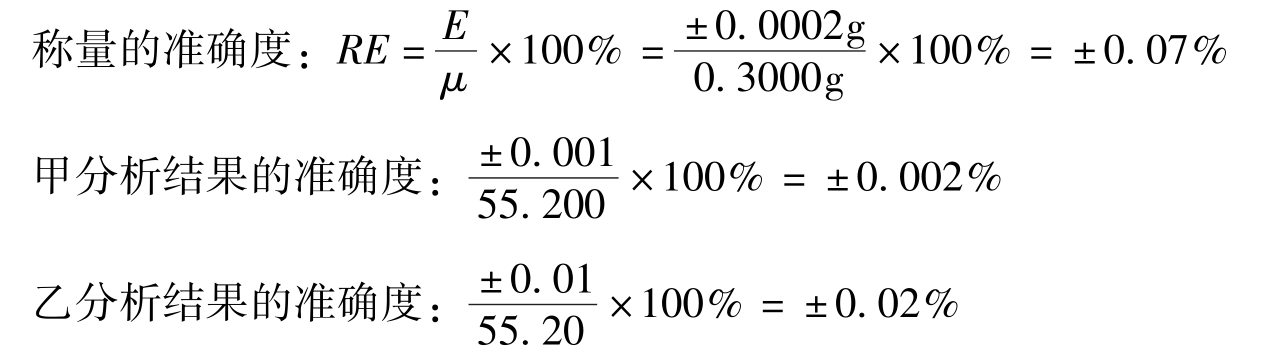
乙的分析结果准确度与称量的准确度一致,而甲的分析结果准确度与称量的准确度不相符,没有意义,因此乙的结果表示正确。通常对于含量≥10%的组分测定,分析的结果一般要求用四位有效数字表示;对于含量在1% ~10%的组分测定,分析结果一般要求用三位有效数字表示;对于含量≤1%的组分测定,分析结果一般要求用两位有效数字表示。
定量分析中,得到一组分析数据后,必须将这些分析数据加以处理。数据处理的任务是通过对少量或有限次实验测量数据的合理分析,来正确、科学地评价分析结果,并用一定的方式将分析结果表示出来。
在分析工作中,常常会遇到一组平行测定所得的数据中有个别数据过高或过低,这种数据称为可疑值,也称为异常值或逸出值。可疑数据对测定的精密度和准确度均有很大的影响。可疑数据可能是偶然误差波动性的极度表现,也可能是测量时的过失引起。因此,可疑数据不能凭个人主观愿望任意取舍,要按一定的统计学方法进行处理,决定其取舍。统计学处理可疑值的方法有多种,目前常用的方法是 Q -检验法和 G -检验法。
当测定次数 n =3~10次时,用 Q -检验法决定可疑值的取舍是比较合理的方法。其具体步骤如下:
1.将所测得的数据按递增的顺序排列,可疑值排在序列的开头或末尾。
2.计算出可疑值与其邻近值( x 邻近 )之差的绝对值。
3.算出序列中最大值与最小值之差(极差)。
4.用可疑值与其邻近值之差的绝对值除以极差,所得的商称为舍弃商 Q 。即:

5.查 Q 值表2-1,如果 Q 计 ≥ Q 表 ,将可疑值舍去,否则保留。
表2-1 不同置信度下的 Q 值表
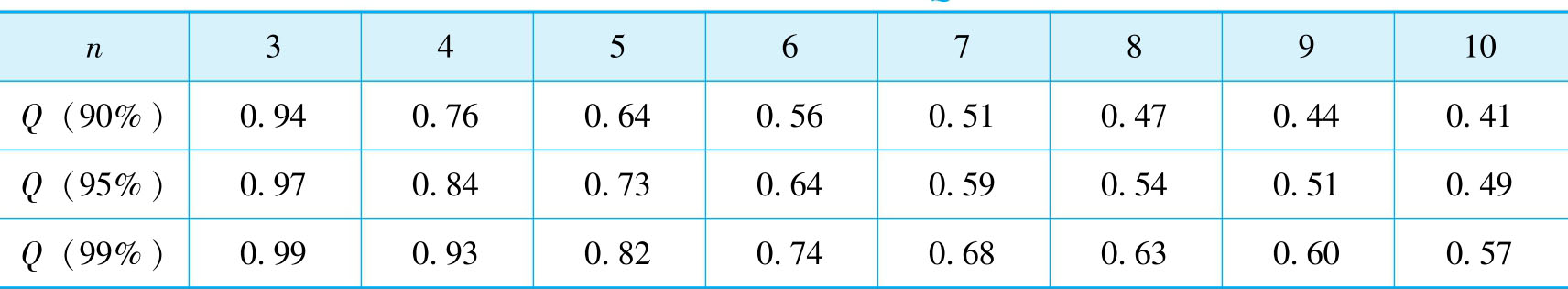
例2-3 某一测定中平行测定四次得到以下数据:0.1019mol·L -1 、0.1014mol·L -1 、0.1012mol·L -1 、0.1016mol·L -1 。试用 Q -检验法判断置信度为95%时,测量值0.1019mol·L -1 是否应该舍弃?
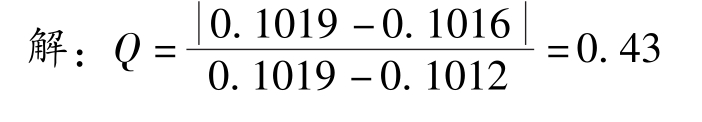
查表2-1得:当n=4,置信度为95%时, Q 表 =0.84。因为 Q 计 < Q 表 ,所以测量值0.1019mol·L -1 不能舍弃。
G -检验法的适用范围较 Q -检验法广,准确度更高,因此该方法是目前应用较多的检验方法,其具体步骤如下:
1.计算出包括可疑值在内的平均值。
2.计算出包括可疑值在内的标准偏差。
3.按下列公式计算 G 值:

查 G 值表2-2,如果 G 计 ≥ G 表 ,将可疑值舍弃,否则保留。
表2-2 95%置信度的 G 临界值表

例2-4 用G-检验法判断例2-3中的数据0.1019是否应舍弃?
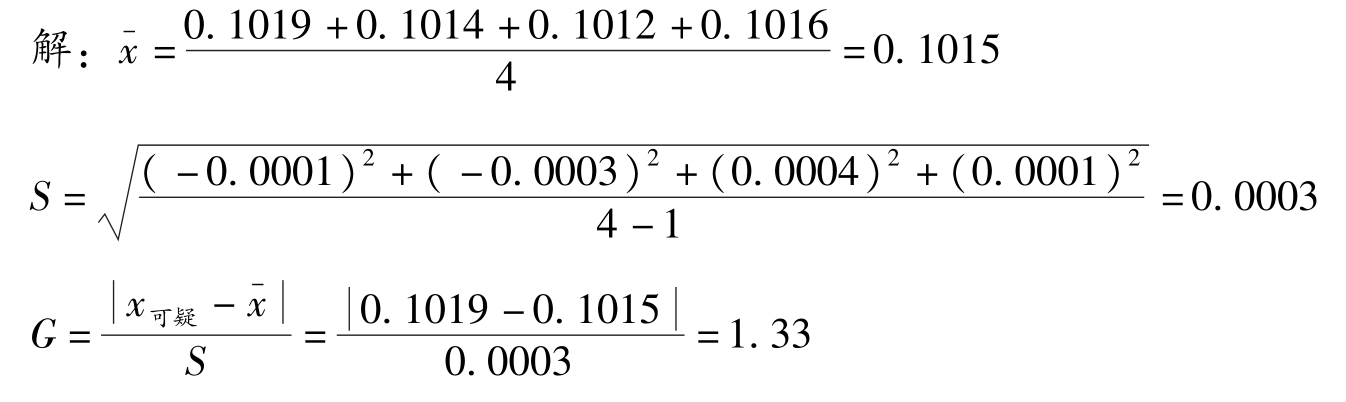
查表2-2得: n =4时, G 表 =1.48,因为 G 计 < G 表 ,故数据0.1019不应舍弃。此法与 Q -检验法判断一致。
在系统误差可忽略的情况下,进行定量分析实验,一般是对每个试样平行测定3~5次,得到一组测定值。首先看是否有可疑值,并判断可疑值是否应舍弃,然后计算测定结果的平均值,再计算出结果的相对平均偏差。一般来说,如果相对平均偏差≤0.2%,可认为符合要求,取其平均值报告分析结果。否则,此次实验不符合要求,需重做。
但对于准确度要求较高的分析,如制定分析标准、涉及重大问题的试样分析等,就不能这样简单地处理。需要多次对试样进行平行测定,将取得的多个数据用数理统计的方法进行处理。
平均值的精密度可用平均值的标准偏差( S x -)表示,而平均值的标准偏差表示如下:

可以看出,
n
次测量平均值的标准偏差是1次测量标准偏差的
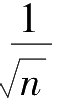 倍,即
n
次测量的可靠性是1次测量的
倍,即
n
次测量的可靠性是1次测量的
 倍。由此推算,4次测量的可靠性是1次测量的2倍,25次测量的可靠性是1次测量的5倍。测量次数的增加与可靠性的增加不成正比,增加测量次数可以减小偶然误差的影响,提高测量的准确度,但过多增加测量次数并不能使准确度显著提高。
倍。由此推算,4次测量的可靠性是1次测量的2倍,25次测量的可靠性是1次测量的5倍。测量次数的增加与可靠性的增加不成正比,增加测量次数可以减小偶然误差的影响,提高测量的准确度,但过多增加测量次数并不能使准确度显著提高。
在准确度要求较高的分析工作中,需要对测定平均值进行估计。真实值 μ 所在的范围称为置信区间,在对 μ 的取值区间进行估计时,应指明这种估计的可靠性或概率,将 μ 落在此范围内的概率称为置信概率或置信度,用 P 表示。由此说明测定平均值的可靠程度。
估计真实值 μ 的置信区间,实际上是对偶然误差进行统计处理。但这种统计处理必须要在消除或校正系统误差的前提下进行。
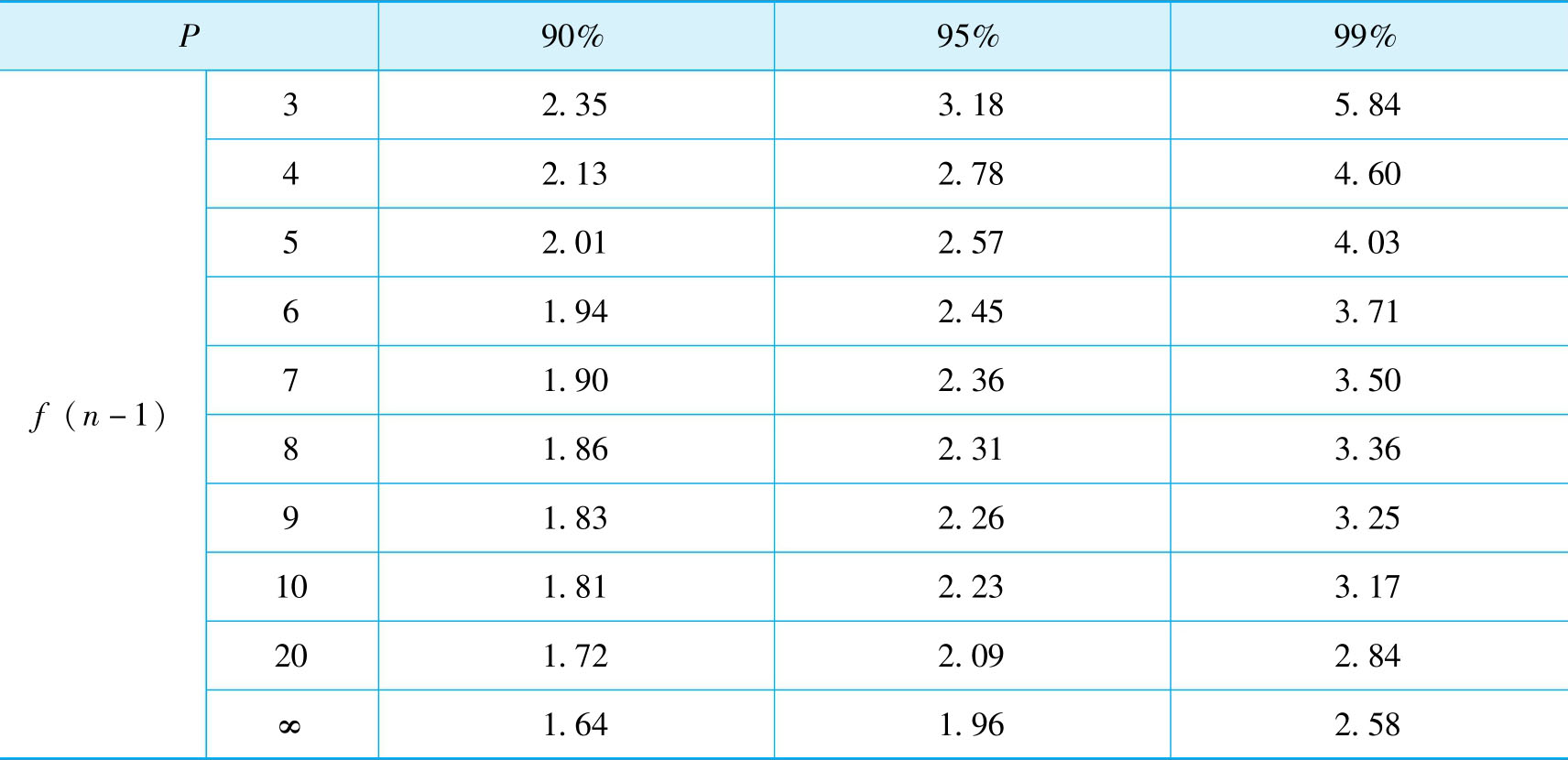
在实际分析工作中,通常对试样进行的是有限次数测定。为了对有限次测量数据进行处理,在统计学中引入统计量t代替 μ 。 t 值不仅与置信度 P 有关,还与自由度 f ( n -1)有关,故常写成 t (p,f) 。当 f →∞时, t → μ 。所以,对于有限次数的测量,其平均值的置信区间为:

不同置信度 P 及自由度 f 所对应的 t 值已计算出来,见表2-3,可供查用。
表2-3 t分布表
例2-5
测定某试样中铁的含量,平行测定10次,测定的
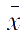 =10.80%,
S
=0.04%,估计置信度为95%或99%时平均值的置信区间。
=10.80%,
S
=0.04%,估计置信度为95%或99%时平均值的置信区间。
解:查表2-3, P =95%, f =10-1=9时, t =2.26;P=99%, f =10-1=9时, t =3.25。
(1)95%置信度时置信区间为:
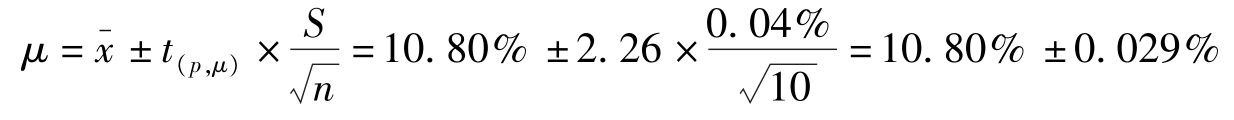
即真实值在10.77%~10.83%间的概率为95%。
(2)99%置信度时置信区间为:
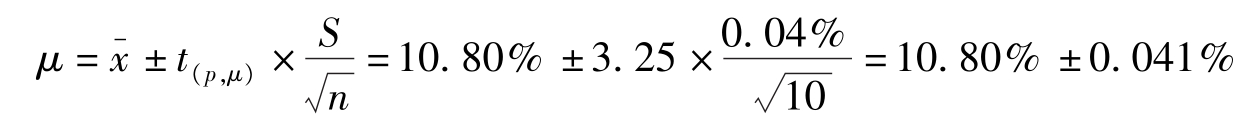
即真实值在10.76%~10.84%间的概率为99%。
由此可见,增加置信度需扩大置信区间。另外,在相同的置信度下,增加 n ,可缩小置信区间。
1.掌握电子天平操作方法及注意事项。
2.掌握直接称量法、减重称量法、固定质量称量法的基本操作。
3.熟悉电子天平结构。
4.了解电子天平的基本原理。
分析天平是定量分析中最常用的一类精密称量仪器。按结构可分为电子天平、等臂双盘电光天平、不等臂单盘减码式电光天平等。
常用的电子天平的称量方法有直接称量法、减重称量法、固定质量称量法等。
电子天平有去皮功能(去皮键“Tare”),应巧妙利用该功能进行操作。
使用电子天平前如需进行校准可采用内校与外校两种方法。外校时,根据天平显示器显示的砝码质量,添加相应的校正砝码,待稳定后,天平显示读数为校正砝码的质量;移走砝码,显示器应显示0.0000g。若显示不为零,则再清零,重复以上校准操作。自动内校的电子天平,可直接自动校准,不用砝码。当电子天平显示器显示为零位时,说明电子天平已经内校准完毕。
1.仪器 托盘天平、电子天平、干燥器(180mm)、称量瓶(25mm×40mm)、锥形瓶(250mL)、 烧杯(50mL)、 滴瓶(30mL)、 药匙。
2.试剂 基准物质无水碳酸钠、NaCl溶液。
1.清扫 取下天平罩,折叠整齐。用软毛刷清扫电子天平的秤盘等。
2.检查、调水平 天平开机前,应观察天平水平仪内的水泡是否位于圆环中央,否则应调节天平的水平调节螺丝至天平水平。
3.预热 天平在初次接通电源或长时间断电后开机时,至少需要30分钟的预热时间。因此,为保证称量效果,天平最好保持在待机状态,不要时刻拔断电源。
4.校准 如果需要校准天平,应根据天平型号选择合适的校准方法。
1.直接称量法 首先用托盘天平粗称小烧杯的质量,检查是否超过电子天平称量范围。然后将小烧杯轻放在电子天平的秤盘中央,关闭天平门。待读数稳定后按“去皮”键(Tare),显示“0.0000”g后,打开天平门,用药匙将一定质量无水碳酸钠加入小烧杯中,这时天平显示的数据即为加入样品的质量,记录数据。
2.减重称量法
(1)准确称取0.3g基准物质无水碳酸钠 用托盘天平粗称装有无水碳酸钠基准物质的称量瓶后,将称量瓶轻放入电子天平称盘中央,关闭天平门。按去皮键“Tare”清零后。用手套或纸条取出称量瓶,用瓶盖轻敲称量瓶上口,将瓶中无水碳酸钠少量倾入洗净的锥形瓶中,将称量瓶放回天平称盘,关闭天平门,读数。天平显示的负值即称量瓶中的质量减少量,也就是锥形瓶中无水碳酸钠的加入量。反复上述操作直到准确称取0.3g样品,记录数据。
(2)准确称取0.7g NaCl溶液 用托盘天平粗称装有NaCl溶液的小滴瓶,然后用手套或纸条将小滴瓶放在电子天平称盘中央,关闭天平门,按去皮键“Tare”清零。打开天平门,用手套或纸条小心取出滴管,将NaCl溶液滴入锥形瓶中,放回滴管,这时天平显示负值,即滴入锥形瓶中NaCl溶液的质量。反复上述操作,直至准确称取0.7g。
3.固定质量称量法 称取0.2000g无水碳酸钠:粗称后,将一干燥的小烧杯放入电子天平称盘,去皮。用药匙取一定量无水碳酸钠,从天平门伸入,将药匙中无水碳酸钠少量、缓慢抖入小烧杯中,直至天平读数恰好为“0.2000”g,关闭天平门。再次确定电子天平读数,并记录数据。如果加多了,用药匙取出一定量样品,重复上述操作。
按“去皮” 键(Tare)显示“0.0000g” 后,按开关键“ON/OFF”。用软毛刷清扫称盘,罩上天平罩。

1.为什么用电子天平称量前,需要先用托盘天平粗称?
2.称量时为什么需要使用手套或纸条接触称量瓶及称量瓶盖?
3.电子天平的基本原理是什么?它的准确度与哪些因素有关?
本章主要介绍误差的分类、表示方法与减小误差提高准确度的方法,有效数字的概念及应用。
1.基本术语和概念:系统误差、偶然误差、绝对误差、相对误差、精密度、相对平均偏差、标准偏差、空白试验、对照试验、有效数字。
2.误差的分类:系统误差和偶然误差。
3.表示准确度的方法:绝对误差、相对误差;表示精密度的方法:相对平均偏差、标准偏差。
4.提高准确度的方法:选择适当的分析方法、减小测量误差、减小偶然误差、减小系统误差。
5.有效数字的记录、修约与计算方法。
6.可疑值的取舍: Q -检验法、 G -检验法。
7.误差的有关计算:
(1)准确度的表示方法:绝对误差( E )=测量值( x )-真实值( μ )
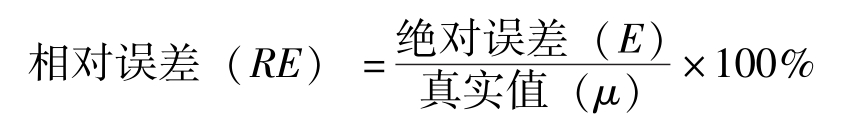
(2)精密度的表示方法:
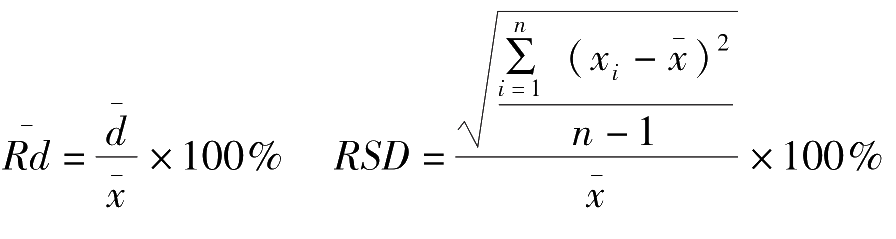
(3)可疑值的取舍:
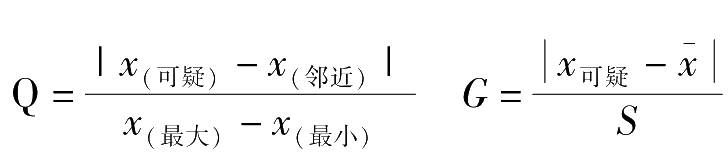
复习思考
一、选择题
1.下列叙述错误的是( )
A.方法误差属于系统误差 B.系统误差又称可定误差
C.系统误差成正态分布 D.系统误差包括操作误差
2.下列措施为减小偶然误差的是( )
A.空白试验 B.对照试验 C.回收试验 D.多次测定取平均值
3.偶然误差产生的原因不包括( )
A.实验方法不当 B.温度的变化 C.湿度的变化 D.气压的变化
4.精密度的表示方法不包括( )
A.绝对偏差 B.相对误差 C.相对平均偏差 D.标准偏差
5.一次成功的测量结果应是( )
A.精密度高,准确度高 B.精密度高,准确度差
C.精密度差,准确度高 D.精密度差,准确度差
6.下列测量值中,不是四位有效数字的是( )
A.10.00mL B.0.1234g C.pH=10.00 D.20.10%
二、判断题
1.多次平行测定得到的数据都很接近,说明测定结果精密度好,准确度高。( )
2.有效数字是指在分析工作中能准确测量到,并有实际意义的数。( )
3.系统误差可正可负,具有随机性。( )
4.精密度体现了误差的大小。( )
5.如果平行测定的一组数据中,有一个明显和其他数据相差比较大,应该直接舍去该数据,再由其他数据求平均值,这样得到的分析结果更准确。( )
6.用同一台天平称量时,称量的样品质量越大,则称量误差越小。( )
三、简答题
1.误差分为哪两类,分别有什么特点和规律性?
2.准确度与精密度的关系是什么?
3.定量分析一般有哪些步骤?
4.将下列数据修约为三位有效数字:
(1)28.25 (2)0.3215 (3)3.26501
四、计算题
1.测定某样品时,滴定液消耗体积为20.00mL,已知滴定管读数误差为±0.02mL,则滴定管的相对误差为多少?
2.用酸碱滴定法测定氢氧化钠溶液浓度,平行操作3次得到的结果分别为0.1085mol·L -1 、0.1035mol·L -1 、0.1092mol·L -1 ,计算相对平均偏差和相对标准偏差,并根据计算结果判断这次测定的精密度是否符合滴定分析的要求。