紧接着,我们打算用一页篇幅解释量子力学。(如果觉得这一节太过专业,你可以跳过它。本书结束时不用考试。)
每一种元素都由它的原子序数来定义,原子序数是该元素的每一个原子的核中带正电荷的质子的数目。这些质子和数目相等的带负电荷的电子相匹配,这些电子存在于围绕着核的“轨道”中。我把“轨道”打上引号,是因为实际上电子并不像行星围绕着恒星那样围绕着轨道运行。事实上,我们根本不能说电子是在运行。
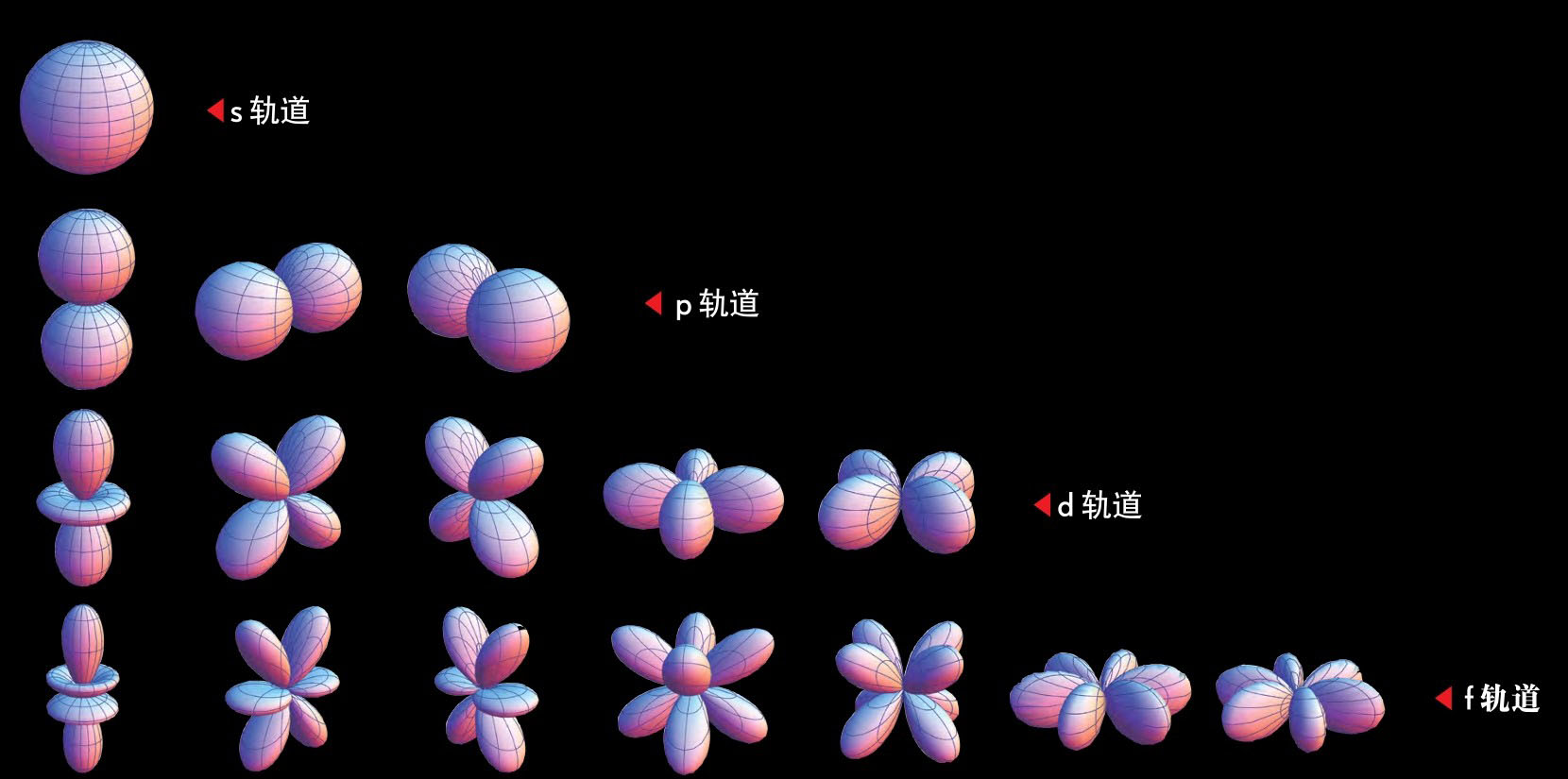
相反,每一个电子都是作为概率云存在的,在一个地方的可能性比在另一个地方要大一些,但实际上在任何给定的时间里不在任何一个地方。以下的图显示了围绕着核的电子概率云的各种三维形状。
第一种称为s轨道。它是完全对称的,不能说电子处于这个方向或者另一个方向。第二种称为p轨道。它有两个瓣,这意味着电子更可能处在核的这一侧或另一侧,而比较不可能处在二者之间的方向上。
虽然s轨道只有一个,但p轨道却有三个,指向空间的三个互相垂直的方向(x, y,z)。类似地,d轨道有五个不同的类型,f轨道有七个不同的类型,瓣的数目也逐渐增加。(你可以把这些形状想像为三维驻波。)
每一种形状的轨道都可以有各种大小,例如,1s轨道是个小球,2s轨道是个比较大的球,3s轨道是个更大的球,等等。随着轨道越来越大,处于轨道中的电子所需要的能量也增大。在其他条件都相同的情况下,电子总是停留在最小的、能量最低的轨道中。
那么,是不是原子中的所有电子都一块儿呆在能量最低的1s轨道中呢?不,在这里我们要讲一讲量子力学早期历史中最基本的发现之一:两个粒子不可能同时处在完全相同的量子态中。因为电子具有一种称为“自旋”的内部状态,自旋可以是向上的也可以是向下的。这就是说,在一个给定的轨道中正好可以居住两个电子——一个向上自旋,一个向下自旋。
氢只有一个电子,因此电子就住在1s轨道中。氦有两个电子,刚好放入1s轨道,满足了它可以容纳两个电子的容量。锂有三个电子,由于1s轨道已经没有多余的空间,第三个电子被迫呆在较高能量的2s轨道中。依此类推,每次都按照递增的能量次序来填满轨道。
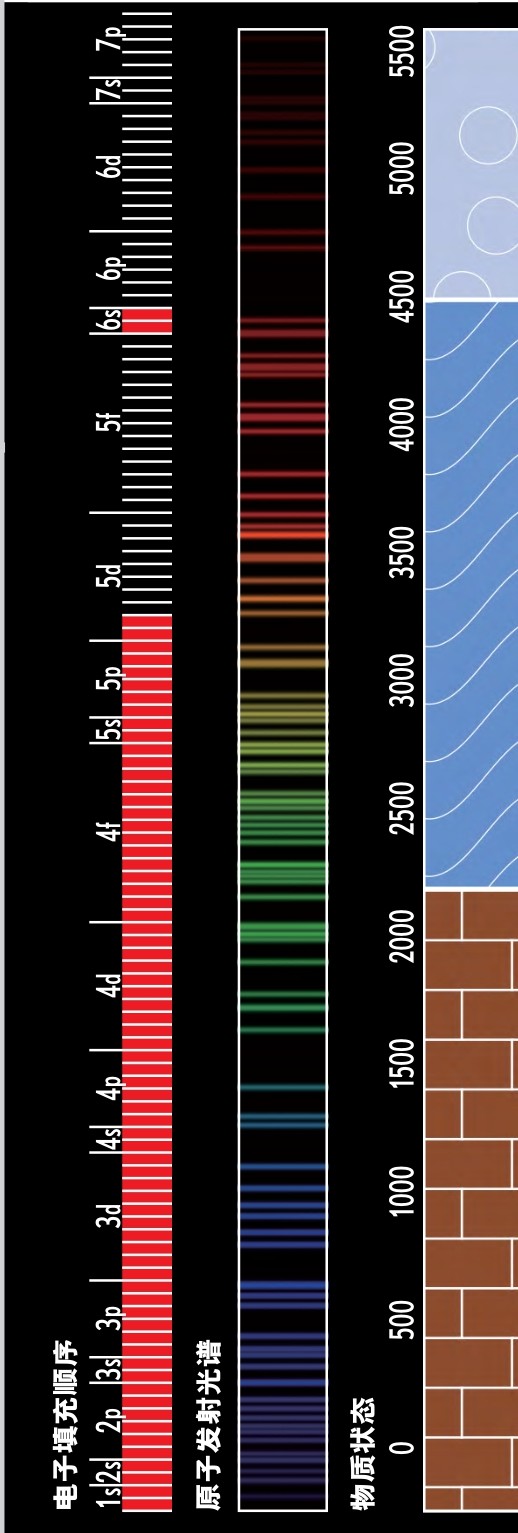
看看本书任何一页右边的电子填充顺序图,你就会看到从1s到7p的可能的电子轨道图,用红条码表示哪一个轨道已经被电子填满(7p是已知元素中被电子占据的能量最高的轨道)。轨道填充的准确顺序是出人意料地微妙和复杂的。在你浏览本书的时候可以偶然看一下。请特别注意钆(64)前后的元素,如果你以为你已经估计出了它们的轨道填充顺序,你的自信心就可能被那里所发生的事动摇。
正是这个填充顺序决定了元素周期表的形状。开头的两个纵列代表填充s轨道的电子数。接着的十个纵列是填充五个d轨道的电子数。最后的六个纵列是填充三个p轨道的电子数。最后,但并非最不重要的是,14种稀土元素是填充七个f轨道的电子数。(如果你问自己,为什么第2号元素氦不是放在第4号元素铍的上面,那么我祝贺你,你已经像一位化学家而不是像一位物理学家那样思考问题了。本书参考文献中Eric Scerii的书对于回答这类问题是一本很好的入门书。)
元素周期表
你需要知道每一件事,没有一件事是你不需要知道的。


导航图
相应于每种元素的每一页都有一个小小的图,图中有一个用黄颜色照亮的方块,用来表示本页元素在周期表中的位置。对于将周期表分成几个组的颜色,已在前面几页中加以叙述。


原子量
一种元素的原子量(请不要和原子序数混淆)是该元素典型样品中每个原子的平均质量,用“原子质量单位”或amu表示。amu定义为碳-12原子质量的1/12。粗略地说,一个amu是一个质子或一个中子的质量,因此,元素的原子量大致等于该原子的核中质子和中子的总数。
然而,你将会看到,有些元素的原子量处在两个完整的整数之间。当一种元素的典型样品含有两个或多个天然存在的同位素的时候,这些同位素的平均重量就使得amu表现为分数。(同位素将在第91号元素镤那一部分更详细地解释,它的基本概念是,一种元素的同位素都拥有相同数目的质子,因此具有相同的化学性质,只是原子核中的中子数目不同。)
密度
元素的密度定义为绝对纯的该元素的假定无瑕疵的单晶的理想化密度。这在实践中永远无法实现,因此元素密度一般是由原子量和晶体中原子间隔的X射线晶体学测量值的组合来计算的。密度的单位是克/厘米 3 。
原子半径
物质的密度取决于两个因素:每一个原子有多重以及每一个原子占据多大空间。每种元素的原子半径是计算出来的从原子核到最外层电子的平均距离,单位是皮米(pm,1米的一万亿分之一)。原子半径旁边的图是示意性的,显示了在各自层壳中的所有电子,总尺寸和原子的尺寸相匹配,但各个电子的位置不成比例,更不是说这些电子是围绕着原子自旋的小圆点。虚线的蓝色参考圆圈表示所有原子中最大的原子(第55号元素铯)的半径。
晶体结构
当元素处在其最常见的晶体形态时,晶体结构图表示原子的排列(晶胞重复,形成了整个晶体)。对于常态下是气体或液体的元素,这是它们在被冷却到足够形成凝结固态的时候所呈现的晶体形态。
电子填充顺序
该图显示电子填充可用的原子轨道的顺序,原子轨道已经在上一页详细解释。
原子发射光谱
当把一种元素的原子加热到极高的温度时,它们会发射出特征性波长的光或颜色。特征性波长的光或颜色相应于该原子的电子轨道之间的能级差。该图显示出这些线的颜色,每一条线都相应于特定的能级差,按照从顶端的肉眼可见的红色到底部的接近紫外来排列成光谱。
物质的状态
这一支摄氏温度标尺显示温度范围,在该范围中元素是固体、液体或气体。固体和液体之间的边界线是熔点,而液体和气体之间的边界线就是沸点。请扭动本书的书页,把书页的边缘扩展出来,你将会看到熔点和沸点的曲线图,它们跨越周期表显示出极为明显的趋向。